微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)2005年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si—4.5%—5.5%,Cu—1.0%—1.5%,Mg—0.4%—0.6%,其余为Al。
现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:
①称取18.0 g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O====Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512 g,收集得到的两份气体的体积相差851.2 mL(标准状况下)。
试完成下列问题:
(1)样品中Si和Mg的物质的量分别是多少?
(2)通过计算判断该品牌的铸造铝合金是否为合格产品。
参考答案:(1)0.02 mol? 0.002 mol
(2)不合格产品
本题解析:(1)设9 g样品中所含Si的物质的量为x,Mg的物质的量为y。
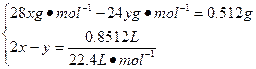
解得:x="0.02" mol,y="0.002" mol
(2)因为合金中Si的百分含量为:0.02 mol×28 g·mol-1÷9 g×100%=6.2%,超过国家标准,故该铸造铝合金属于不合格产品。
本题难度:一般
2、选择题 甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是
A.参加反应的H2SO4为0.2mol
B.参加反应的NaOH约为0.27mol
C.加入铝粉的质量A=5.4
D.与硫酸反应的铝粉的质量7.2g
参考答案:B
本题解析:如果铝完全反应则生成的氢气体积是相等的,但由于反应结束后生成的氢气体积为甲:乙=3:4,这说明铝与稀硫酸反应时硫酸不足,铝过量。与氢氧化钠溶液反应时铝完全反应,氢氧化钠过量或恰好反应。A、硫酸的物质的量=0.1L×3mol/L=0.3mol,即参加反应的硫酸是0.3mol,A不正确;B、硫酸生成的氢气是0.3mol,所以氢氧化钠与铝反应生成的氢气是0.4mol,则根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的氢氧化钠是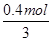 ×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量=
×2=0.27mol,B正确;C、根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,参加反应的铝的物质的量=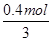 ×2,质量=
×2,质量=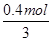 ×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。
×2×27g/mol=7.2g,C不正确;D、根据反应2Al+3H2SO4=Al2(SO4)3+3H2↑可知,参加反应的铝的质量=0.2mol×27g/mol=5.4g,D不正确,答案选B。
本题难度:一般
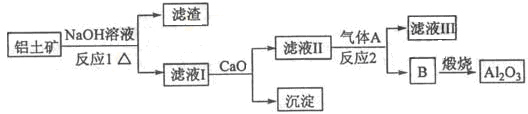
3、填空题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
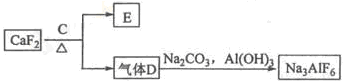
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式?;
(2)滤液Ⅰ中加入CaO生成的沉淀是?,反应2的离子方程式为?;
(3)E可作为建筑材料,化合物C是?,写出由D制备冰晶石的化学方程式?;
(4)电解制铝的化学方程式是?,以石墨为电极,阳极产生的混合气体的成分是?。
参考答案:(1)2NaOH+SiO2=Na2SiO3+H2O? 2NaOH+Al2O3=2NaAlO2+H2O
(2)CaSiO3?2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(3)浓H2SO4? 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(4)2Al2O3 4Al+3O2↑ ?O2、 CO2?、CO
4Al+3O2↑ ?O2、 CO2?、CO
本题解析:(1)铝土矿的主要成分是Al2O3和SiO2等.当向铝土矿中加入氢氧化钠溶液时发生反应2NaOH+SiO2=Na2SiO3+H2O? 2NaOH+Al2O3=2NaAlO2+H2O。产生的Na2SiO3和NaAlO2在滤液Ⅰ中。向滤液中加入CaO发生反应CaO+H2O=Ca(OH)2 Ca(OH)2+ Na2SiO3=CaSiO3↓+2NaOH. NaAlO2仍然留在滤液Ⅱ中。这时通入CO2气体。发生反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。B是Al(OH)3。滤液Ⅲ含有碳酸钠。Al(OH)3受热分解2 Al(OH)3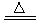 Al2O3+3H2O. 电解氧化铝得到单质Al。由于Al2O3熔点很高,有2000多度。为了能使氧化铝在较低的温度下融化,要加入助溶剂冰晶石。它的制法是用萤石和浓硫酸在加热时发生反应硫酸钙和HF。硫酸钙用于建筑材料,由HF和碳酸钠、氢氧化铝发生反应产生冰晶石。12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。这样在冰晶石作用下1000度左右氧化铝就能融化,发生反应:2Al2O3
Al2O3+3H2O. 电解氧化铝得到单质Al。由于Al2O3熔点很高,有2000多度。为了能使氧化铝在较低的温度下融化,要加入助溶剂冰晶石。它的制法是用萤石和浓硫酸在加热时发生反应硫酸钙和HF。硫酸钙用于建筑材料,由HF和碳酸钠、氢氧化铝发生反应产生冰晶石。12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。这样在冰晶石作用下1000度左右氧化铝就能融化,发生反应:2Al2O3 4Al+3O2↑。制的Al. 以石墨为电极电解氧化铝时,阳极发生氧化反应产生氧气。但由于温度高,部分氧气和石墨电极发生反应产生CO、CO2.故阳极产生的混合气体的成分是O2、CO2? CO.
4Al+3O2↑。制的Al. 以石墨为电极电解氧化铝时,阳极发生氧化反应产生氧气。但由于温度高,部分氧气和石墨电极发生反应产生CO、CO2.故阳极产生的混合气体的成分是O2、CO2? CO.
本题难度:困难
4、选择题 向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和Na[Al(OH)4]的澄清溶液,则加入金属钠的质量是( )
A.3.45 g
B.2.3 g
C.1.15 g
D.0.575 g
参考答案:B
本题解析:100 mL 0.25mol/L的AlCl3溶液中n(Al)=0.001×100L×0.25mol/L=2.5×10-2mol,
n(Cl)=0.001×100L×3×0.25mol/L=7.5a×10-2mol,
则加入的Na的物质的量为:2.5×10-2mol+7.5×10-2mol= 10-1mol=0.1mol,即2.3g。
故选B。
点评:本题考查物质的量的计算,题目难度中等,注意从元素守恒的角度解答较为简单,可省去书写化学方程式的中间过程。
本题难度:简单
5、填空题 (共10分)在铝制易拉 罐中收集满CO2,然后倒入10mL浓NaO
罐中收集满CO2,然后倒入10mL浓NaO H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
H溶液,迅速密封易拉罐口,可以观察到易拉罐突然变瘪了,原因是 _____________________,反应的离子方程式为 ___________________。
一段时间后,又可以观察到 ______________________,
原因是 ______________________,反应的化学方程式为
___________________ ___________。
___________。
参考答案:

本题解析:略
本题难度:一般