微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关金属及其合金的说法不正确的是
[? ]
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖有氧化膜,对内部金属起保护作用
参考答案:B
本题解析:
本题难度:简单
2、填空题 证明Al2O3具有两性的反应事实是______________________(用离子方程式表示)。
参考答案:Al2O3 + 2OH— 2AlO2— + H2O? Al2O3 + 6H+
2AlO2— + H2O? Al2O3 + 6H+ 2Al3+ + 3H2O
2Al3+ + 3H2O
本题解析:既能和酸反应,也能和碱反应生成盐和水的氧化物是两性氧化物,据此可知,能证明Al2O3具有两性的反应事实是Al2O3 + 2OH— 2AlO2— + H2O、Al2O3 + 6H+
2AlO2— + H2O、Al2O3 + 6H+ 2Al3+ + 3H2O。
2Al3+ + 3H2O。
点评:该题基础性强,侧重对学生基础知识的巩固,旨在培养学生灵活运用基础知识解决实际问题的能力的培养,难度不大。该题的关键是明确两性氧化物的含义以及判断依据,有利于培养学生规范的答题能力。
本题难度:一般
3、填空题 有关物质间转化关系如下图,试回答:
 ?
?
(1)转化①的反应条件为? .
(2)转化②的化学方程式为?.转化③的离子方程式为?.
(3)若转化⑤用于实验室制Al(OH)3,则试剂A宜选择?(填名称).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,结果Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为?或?mL。
参考答案:(1)电解
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
Cl2↑+Mn2++2H2O
(3)氨水
(4)150ml、550ml
本题解析:
试题解析:(1)由氧化铝制取铝单质,通过电解的方法。
(2)转化②是指铝和氢氧化钠溶液的反应,所以方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,转化③是指二氧化锰与浓盐酸反应制取氯气,所以离子方程式为MnO2+4H++2Cl- Cl2↑+Mn2++2H2O。
Cl2↑+Mn2++2H2O。
(3)因为氢氧化铝易溶解于强碱溶液,所以制备氢氧化铝时常用弱碱溶液氨水。
(4)由题意可知氯化铝的物质的量为0.15mol, Al3+离子有1/3转化为Al(OH) 3时,有两种情况:一、NaOH不足,这时有0.05mol的Al(OH) 3生成则需要NaOH0.15mol,体积为150ml;二、NaOH过量时,生成0.15mol的Al(OH) 3需要0.45mol的NaOH,再溶解0.1mol的Al(OH) 3需要0.1mol的NaOH,所以共需要0.55mol的NaOH,体积为550ml。
本题难度:一般
4、选择题 把铝粉和Fe2O3粉末配成铝热剂,分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的稀盐酸反应;后一份直接加入足量的NaOH溶液使之充分反应,前后两种情况下生成气体的物质的量之比为? ( )
A.3∶2
B.2∶3
C.3∶4
D.4∶3
参考答案:B
本题解析:令每份都含有1molAl:
(1)对于在高温下恰好完全反应,再与足量稀硫酸反应,根据方程式可得
2Al~2Fe~2H2
2? 2? 2
1mol?1mol?1mol
对于直接放入足量的烧碱溶液中,根据方程式可得
2Al~3H2?
2?3
1mol?1.5mol
相同条件下,体积之比等于物质的量之比,前后两种情况下生成气体的物质的量之比为2:3。
点评:本题考查混合物的计算、铝的性质,难度中等,关键清楚反应过程.注意铁与硫酸反应生成硫酸亚铁。
本题难度:简单
5、填空题 各种无机盐在原生质中占有一定的比例。若以人体体液中的Na+的含量为100,则K+为3.68,Ca2+为3.10,Mg为0.70,Cl-为12 900,Al3+含量极低。这种比例和海水的成分近似。试完成下列问题:
(1)上述事实说明了什么问题?
(2)铝元素对人体有害,1989年世界卫生组织把铝列为食品污染物之一,每日摄入量应控制在4 mg以下。问铝元素含量较多会引发人体什么疾病。
(3)油条是中国北方常见食品之一。油条的制作口诀是“一碱、二矾、三食盐”,其中的“碱、矾、盐”分别指什么物质?写出炸油条时发生反应的化学方程式。
(4)炸油条时,1 kg面粉需加0.5 kg水、4 g矾、10 g碱和盐等辅料,若在油炸过程中质量减少20%,试通过计算说明100 g油条中的含铝量是否超过安全摄入量。
参考答案:(1)原始生命最早起源于原始海洋。(2)老年性痴呆。(3)“碱”指NaHCO3;“矾”指明矾KAl(SO4)2·12H2O;“盐”指NaCl。2KAl(SO4)2+6NaHCO3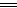 K2SO4+3Na2SO4+2Al(OH)3↓+6CO2↑。(4)超过。
K2SO4+3Na2SO4+2Al(OH)3↓+6CO2↑。(4)超过。
本题解析:(1)原始生命最早起源于原始海洋。(2)铝主要损害脑细胞,是老年性痴呆的原因之一。(3)“碱”指NaHCO3;“矾”指明矾KAl(SO4)2·12H2O;“盐”指NaCl。2KAl(SO4)2+6NaHCO3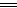 K2SO4+3Na2SO4+2Al(OH)3↓+6CO2↑。(4)4 g明矾中含铝为:4 g×27/474="0.228" g;熟油条的质量为:1 514 g×80%="1" 211 g;100 g油条中含铝为:100 g×0.228/1 211="0.019" g="19" mg,远远超过4 mg的安全摄入量。
K2SO4+3Na2SO4+2Al(OH)3↓+6CO2↑。(4)4 g明矾中含铝为:4 g×27/474="0.228" g;熟油条的质量为:1 514 g×80%="1" 211 g;100 g油条中含铝为:100 g×0.228/1 211="0.019" g="19" mg,远远超过4 mg的安全摄入量。
本题难度:一般