|
高考化学知识点归纳《热化学方程式》考点预测(2017年强化版)(十)
2017-03-03 00:03:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l) ΔH1="-870.3" kJ·mol-1 2CO2(g)+2H2O(l) ΔH1="-870.3" kJ·mol-1
(2)C(s)+O2(g) CO2(g) ΔH2="-393.5" kJ·mol-1 CO2(g) ΔH2="-393.5" kJ·mol-1
(3)H2(g)+O2(g) H2O(l) ΔH3="-285.8" kJ·mol-1 H2O(l) ΔH3="-285.8" kJ·mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g) CH3COOH(l) CH3COOH(l)
A.ΔH="+488.3" kJ·mol-1
B.ΔH="-244.15" kJ·mol-1
C.ΔH="-977.6" kJ·mol-1
D.ΔH="-488.3" kJ·mol-1
|
参考答案:D
本题解析:所求反应由(2)×2+(3)×2-(1)所得,则ΔH=ΔH2×2+ΔH3×2-ΔH1="-488.3" kJ·mol-1。
本题难度:一般
2、简答题 四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是______.
(2)在②→③工艺中需要控制条件以形成TiO2?nH2O溶胶,该分散质颗粒直径大小在______范围.
(3)若把③中制得的固体TiO2?nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+?Fe3++H2O的平衡常数K=______.
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1;2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:______.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是______(只要求写出一项).
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用______方法.
| TiCl4 | SiCl4
熔点/℃
-25.0
-68.8
沸点/℃
136.4
57.6
参考答案:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:防止Ti3+被Fe3+氧化成TiO2+;
(2)控制条件以形成TiO2?n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+?Fe3++H2O的平衡常数K=c(Fe3+)c3(H+)=c(Fe3+)(10-14c(OH-))3=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103.
故答案为:2.79×103;
(4)①TiO2 (s)+2Cl2 (g)═TiCl4(l)+O2(g)△H=+140KJ?mol-1
②2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ?mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ?mol-1
(5)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(6)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏);
本题解析:
本题难度:一般
3、选择题 2g碳与水蒸气反应生成CO和H2,需吸收21.88kJ热量,此反应的热化学方程式为
A.C + H2O ==CO + H2ΔH =+131.3kJ·mol—1
B.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH =+10.94kJ·mol—1
C.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = -131.3kJ·mol—1
D.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = +131.3kJ·mol—1
|
参考答案:D
本题解析:反应是吸热反应,所以△H大于0,C不正确。A不正确,因为没有标明状态,B中反应热的数值不同,所以正确的答案选D。
本题难度:一般
4、填空题 32.(16分)
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 =" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 =" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol-1.请回答下列问题:
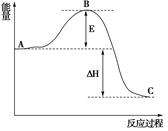
①图中E、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
参考答案:(1)活化能 ; 生成物的能量
(2)无;降低;催化剂改变了反应的历程,使活化能E降低;
(3)-198
本题解析:(1)1g甲烷燃烧放热55 kJ,1mol甲烷是16g,放热为880 kJ;
(2)ΔH =(②-①)/2="+260" kJ/mol;
(3)由图可知该反应为放热反应,E点是反应的活化能,C点是生成物所具有的能量;在反应中加入催化剂能使反应的活化能降低,△H=2×(-99 kJ·mol-1)="-198" kJ·mol-1。
考点:热化学方程式对的书写、反应热的计算
点评:本题相对简单,主要考察了热化学方程式的基本计算,盖斯定律,以及活化能的知识,做题时只要将图看懂即可。
本题难度:一般
5、填空题 (11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g)?CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g)?CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) ?CH3OH (g)+H2(g)的△H= kJ·mol-1。
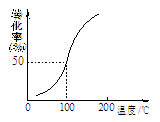
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。
(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的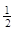 ,对平衡体系产生的影响是 (填序号)。 ,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时,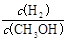 减小, 减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:

①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
参考答案:(1)(2分)+77.0 (2)0.03 (3)②③
(4)①Co2+-e-= Co3+(或6Co2+-6e-=6Co3+) ②6 H2O 6
本题解析:(1)根据盖斯定律,反应CH4(g)+H2O(g)?CH3OH (g)+H2(g)将①+②可得,则△H=(+206.0KJ/mol)+(-129.0KJ/mol)=-77KJ/mol;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O (g)="CO" (g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平衡反应速率V(H2)= ="0.03" mol?L-1?min-1; ="0.03" mol?L-1?min-1;
(3)在一定条件下,将一定量的CO和氢气的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查电化学基础、化学平衡的影响因素。
本题难度:困难
|