|
高考化学知识点归纳《盐类水解的原理》高频试题预测(2017年最新版)(六)
2017-03-03 00:07:01
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中,属于水解反应的是
[? ]
A.HCOOH+H2O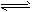 HCOO-+ H3O+ HCOO-+ H3O+
B.CO2+H2O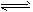 HCO3-+ H+ HCO3-+ H+
C.CO32-+H2O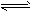 HCO3-+OH- HCO3-+OH-
D.HS-+H2O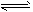 S2-+H3O+ S2-+H3O+
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法不正确的是
A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-)
B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-)
C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡
D.常温常压下能自发进行的反应,一定都是放热反应
|
参考答案:D
本题解析:硫酸铵化学式为(NH4)2SO4,属于强酸弱碱盐,水溶液呈酸性,所以A正确;根据电荷守恒原理可知,溶液中阴离子带的负电荷总数应该等于阳离子带的正电荷,故B正确;Na2CO3属于强碱弱酸盐,水溶液呈碱性,所以滴有酚酞的溶液变红,当加入氯化钡溶液后,生成碳酸钡沉淀和氯化钠溶液,呈中性,故C正确;能否自发进行,除了和焓变有关,与熵变也有关,它们共同决定,故D错误。
考点:考查电离平衡相关知识
本题难度:一般
3、填空题 (1)Na2CO3溶液呈碱性的原因是______(写出有关的离子方程式),(NH4)2SO4溶液呈酸性的原因是______(写出有关的离子方程式),将NaHCO3溶液跟Al2(SO4)3溶液混合,相关反应的离子方程式是______.
(2)有浓度均为0.2mol/L的Na2CO3溶液与NaHCO3溶液,试回答下列问题:
①pH大小:Na2CO3______NaHCO3(填>、=、<);
②微粒种类:Na2CO3______NaHCO3(填>、=、<);
③两溶液分别加入0.1molNaOH固体,恢复到原温度,Na2CO3溶液中的c(CO32-)______(填“增大、减小或不变”)、NaHCO3溶液中的c(HCO3-)______(填“增大、减小或不变”).
(3)常温下,甲为0.1mol/L的HA溶液,pH>1;乙为0.1mol/LBOH溶液,且溶液中c(OH-):c(H+)=1012.请分别写出甲、乙两溶液中溶质的电离方程式______、______.
(4)相同条件下,对于浓度均为0.1mol/L的NaCl溶液和CH3COONa溶液,溶液中的离子总数:NaCl溶液______CH3COONa溶液(填>、=、<).
(5)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵五种溶液中c(NH4+)由大到小的顺序是______.
参考答案:(1)Na2CO3溶液呈碱性是因为碳酸根离子水解生成碳酸氢钠和氢氧化钠离子方程式为:CO32-+H2O?HCO3-+OH-;(NH4)2SO4溶液呈酸性的原因是铵根离子水解生成一水合氨和硫酸,溶液呈酸性,反应的离子方程式为:NH4++H2O?NH3?H2O+H+;将NaHCO3溶液跟Al2(SO4)3溶液混合,铝离子的水解显酸性,碳酸氢根离子水解显碱性,二者混合水解相互促进生成氢氧化铝和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:CO32-+H2O?HCO3-+OH-;NH4++H2O?NH3?H2O+H+;Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(2)①同浓度的碳酸钠溶液水解程度大于碳酸氢钠溶液,溶液pH碳酸钠溶液大于碳酸氢钠,
故答案为:>;
②溶液中存在的微粒种类为Na+、CO32-、HCO3-、H2CO3、H+、OH-所含微粒种类相同,分析碳酸钠溶液中和碳酸氢钠溶液中存在的平衡可知微粒种类相同,故答案为:=;
③依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移,碳酸根离子浓度增大;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行,碳酸氢根离子浓度减小,
故答案为:增大;减小;
(3)甲为0.1mol/L的HA溶液,pH>1,说明酸为完全电离,依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中c(H+)c(OH-)=10-14,根据离子积常数和c(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度为:c(OH-)=10-13mol/L,分析判断BOH是弱碱;依据弱电解质存在电离平衡写出电离方程式为:HA?H++A-,BOH?B++OH-,故答案为:HA?H++A-;BOH?B++OH-;
(4)醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子,溶液中离子积是常数,所以醋酸钠溶液中微粒数减小,故答案为:>;
(5)依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小;
物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵五种溶液中,依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小,c(NH4+)由大到小的顺序是:⑤>④>②>③>①,
故答案为:⑤>④>②>③>①.
本题解析:
本题难度:一般
4、填空题 A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
化合物
| 甲
| 乙
| 丙
| 各元素原子
个数比
| N(A):N(C)
=2:1
| N(A):N(C)
=1:1
| N(B):N(A)
=1:4
| 化合物
| 丁
| 戊
| 己
| 各元素原子
个数比
| N(D):N(B):N(C)
=2:1:3
| N(E):N(F)
=1:3
| N(B):N(F)
=1:4
|
请完成下列问题:
(1)D的离子结构示意图为________,己的空间构型是________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为________ mol。
(3)8 g丙完全燃烧,生成液态水和CO2,放出445 kJ的热量,则丙燃烧的热化学方程式为________。
(4)F的单质与甲反应的离子方程式为________。
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为________。
参考答案:(1) ;正四面体 (2)1 (3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 (4)Cl2+H2O ;正四面体 (2)1 (3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 (4)Cl2+H2O HClO+H++Cl- (5)2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑ HClO+H++Cl- (5)2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑
本题解析:B原子最外层电子数是次外层的两倍,可推知B为碳;在周期表中A的原子半径最小,推得A为氢;C是地壳中含量最多的元素,C是氧;C是F不同周期的邻族元素;E和F的原子序数之和为30,推得F为氯,E为铝;A、D同族,最后推知D为钠。甲为H2O,乙为H2O2,丙为CH4,丁为Na2CO3,戊为AlCl3,己为CCl4。(1)D的离子结构示意图为 ,己的空间构型类似甲烷,为正四面体。(2)1 mol乙的水溶液中加入MnO2,生成氧气,转移电子为1 mol。(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。(4)Cl2+H2O ,己的空间构型类似甲烷,为正四面体。(2)1 mol乙的水溶液中加入MnO2,生成氧气,转移电子为1 mol。(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。(4)Cl2+H2O
本题难度:困难
5、填空题 现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH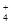 )_________c (Cl—)。 )_________c (Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH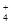 )<c (Cl—),则溶液的pH__________7。 )<c (Cl—),则溶液的pH__________7。
参考答案:(1)=;(2)>;(3)<。
本题解析:(1)根据溶液呈现电中性,阳离子:NH4+、H+,阴离子:OH-、Cl-,c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液的pH=7即c(H+)=c(OH-),得:c(NH4+)=c(Cl-);(2)pH>7溶液显碱性,c(OH-)>c(H+),根据溶液电中性,得出c(NH4+)>c(Cl-);(3)若c(NH4+)<c (Cl—),根据溶液电中性,c(OH-)<c(H+),显酸性pH<7。
考点:考查溶液酸碱性、电中性等相关知识。
本题难度:一般
|