微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 在75℃左右,用HgSO4做催化剂,乙炔可以水化为乙醛。但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液,氧化汞粉末五种物质制乙醛,装置如图所示:
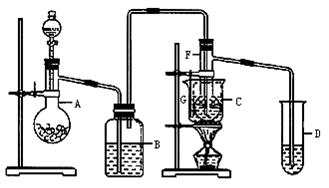
请回答以下问题:
(1)实验开始时,仪器A中盛放电石,B中应装入_______其作用是_______。
(2)仪器D中盛放水,其作用是___________。
(3)蒸馏烧瓶F中应加入氧化汞和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括</PGN0030B.TXT/PGN>氧化汞在内的各试剂的名称:____;将HgO加入F中的操作方法是________。
(4)装置图中,加热F的方式叫____;所选用温度计G的量程表示正确的是________(填序号)。
A.0℃~50℃
B.0℃~100℃
C.0℃~200℃
D.50℃~100℃
E.0℃~360℃
(5)检验乙醛已制出的操作,现象是:____。
参考答案:(1)NaOH溶液;除去气流中的H2S杂质。
(2)吸收生成的乙醛蒸气。
(3)氧化汞,水,浓硫酸;将蒸馏烧瓶横置,用药匙或纸槽将HgO粉末送至底部,再慢慢将烧瓶直立。
(4)水浴加热;(B)
(5)取D中溶液少量,加入新制的Cu(OH)2悬浊液,加热,若产生砖红色沉淀,证明乙醛已生成。
本题解析:本题是一道关于物质的制备和检验以及固、液药品的加入顺序,加热的方法和温度计的使用等基本操作内容的综合性实验题。
从题给条件来看:反应中需HgSO4。从反应装置来看,A为乙炔发生器,B为洗气瓶,F为主反应器;D为吸收器。由反应所需的温度(75℃),可以选择水浴加热方式同时选择量程为0~100℃的温度计较适宜。而对于生成的乙醛的检验,则是利用了醛类物质的通性——跟新制的Cu(OH)2反应生成砖红色沉淀。
本题难度:一般
2、实验题 用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
?①?→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ?②??→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
| 第一次
| 第二次
| 第三次
| 第四次
|
初始读数(mL)
| 0.40
| 0.10
| 0.90
| 0.00
|
最终读数(mL)
| 25.05
| 20.10
| 21.00
| 19.90
|
V标(mL)
| 24.65
| 20.00
| 20.10
| 19.90
|
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________?
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
参考答案:(13分)
(1)①查漏;?②排除滴定管尖嘴处的气泡?(各1分)
(2)酸(1分)
(3)作反应催化剂,加快KMnO4氧化H2C2O4的速率;
溶液由无色变为(紫)红色,半分钟不褪色? (各2分)
(4) 2MnO4— +? 5H2C2O4 +? 6H+ ="=" 2Mn2+ + 10CO2 ↑+ 8H2O?(2分)
(5) 0.25 (2分)
(6) CD?(2分)
本题解析:(1)滴定实验开始就检查滴定管是否合格,为检漏操作,待装液以后要排气泡。(2)KMnO4(H+)溶液具有很强的氧化性,装到酸式滴定管中。(3)MnSO4溶液做为催化剂加快反应速率。(6)A项:无影响;B项:会偏低。
点评:本题考查的是滴定实验操作,学生要注意滴定实验中操作的顺序以及规范操作,且能对有误差能进行分析出来。
本题难度:一般
3、实验题 亚铁盐中,FeSO4?7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4?FeSO4?6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O。
实验室用废铁屑制备莫尔盐的过程如下:

(1)步骤I除锈的操作是:将废铁屑放入烧杯,?,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、?。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]=?。
为了确定(NH4)2SO4的用量,下列方法简便可行的是??(填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和 91Exam.org步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
序号
| 实验方案
| 实验现象和结论
|
步骤1
| 取少量样品?
| 样品颜色可能有变化。
|
步骤2
| 步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________
___________? __ ?。
| 若?,说明样品中含有FeSO4·7H2O杂质。
|
步骤3
| 若步骤2证明样品不含FeSO4?7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。
| 若w1?w2,说明样品中含有(NH4)2SO4杂质。
|
(已知(NH4)2SO4?FeSO4?6H2O的式量为392,(NH4)2SO4的式量为132)
参考答案:(16分)
(1)加入足量稀硫酸(或稀盐酸),充分搅拌?(2分)
(2)酒精灯、温度计 (4分,每空2分)
(3)1∶1? B?(4分,每空2分)
(4)(6分,每空2分)
序号
实验方案
实验现象和结论
步骤1
取少量样品?露置空气一段时间(1分)?
样品颜色可能有变化。
步骤2
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,_加入1~2滴KSCN溶液(2分)__
若溶液变成血红色(2分),说明样品中含有FeSO4·7H2O杂质。
步骤3
若步骤2证明样品不含FeSO4 ·7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。
若w1?>(或大于)(1分)w2,说明样品中含有(NH4)2SO4杂质。
本题解析:(1)废铁屑含有单质铁和铁锈,铁锈主要成分是氧化铁,氧化铁是碱性氧化物,易溶于强酸,生成盐和水,因此步骤I除锈的操作是:将废铁屑放入烧杯,加入足量稀硫酸(或稀盐酸),充分搅拌,过滤,洗涤;(2)水浴加热装置需要的仪器是铁架台、石棉网、大烧杯、酒精灯、温度计;(3)步骤III的原理为FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4?FeSO4?6H2O,该反应中n[(NH4)2SO4]∶n[FeSO4]=1∶1;A项,称取废铁屑的质量,不能推断硫酸铵的量,因此废铁屑中铁锈与单质铁的组成比例未知,过量的无锈铁屑的量未知,不能确定硫酸亚铁的量,故A选项错误;B项,称量无锈铁屑和步骤II之后剩余铁屑的质量,可以计算出与稀硫酸反应时消耗单质铁的量,根据硫酸亚铁与消耗单质铁的系数之比可以求生成的硫酸亚铁的量,进而推算所需(NH4)2SO4的质量,故B选项正确;C项,测定FeSO4溶液的浓度和体积,可以求硫酸亚铁的量,进而推算所需(NH4)2SO4的质量,但是需要进行滴定实验,配制标准酸性高锰酸钾溶液,因此不简便可行,故C选项错误;(4)硫酸铵是白色固体,七水合硫酸亚铁(或绿矾)是绿色固体,在空气中露置时,前者不易变质,而后者则容易被空气中的氧气氧化为铁盐,铁盐固体为黄色,因此样品露置之后颜色可能有变化;硫酸铁、硫酸亚铁都易溶于水,步骤1所得固体用去氧蒸馏水溶解,目的是防止蒸馏水中溶解的氧气氧化亚铁离子,调节至酸性后,加入KSCN溶液,溶液变为血红色,说明存在铁离子,证明样品中含有含有FeSO4·7H2O杂质;摩尔盐或(NH4)2SO4?FeSO4?6H2O中NH4+的质量分数计算表达式为: ×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=
×100%=9.18%,而(NH4)2SO4中NH4+的质量分数计算表达式为:w2=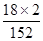 ×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。
×100%=23.68%,因此理论值w2=9.18%,若含有(NH4)2SO4时,w1介于二者9.18%与23.68%之间,所以w1> w2时,说明摩尔盐中含有硫酸铵杂质。
本题难度:一般
4、实验题 (4分)下图是实验室制取溴苯的装置:
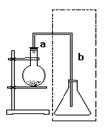
导管a段的作用?。反 应后不久导管b出口可见到白雾,导管b段末端跟锥形瓶里液面保持一段距离的目的是___________________。
应后不久导管b出口可见到白雾,导管b段末端跟锥形瓶里液面保持一段距离的目的是___________________。
参考答案:冷凝回流、导气,防倒吸
本题解析:略
本题难度:一般
5、选择题 右图装置可用于

A.加热NaHCO3制CO2
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓H2SO4反应制HCl
参考答案:B
本题解析:略
本题难度:简单