微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
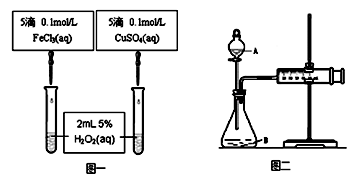
(1)图一可通过观察_____________________________ 现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________________,
你认为还可以作其他何种改进? _____________________________________________。
(2)图二可用于定量比较反应的快慢,检查图二装置气密性的方法是?。
利用图二做实验时需测量的数据是?。
参考答案:(10分)(每空2分)
(1)反应产生气泡快慢(或反应完成的先后或试管壁的冷热程度)?(2分)
控制阴离子相同,排除阴离子的干扰(2分)
将FeCl3改为Fe2(SO4)3?(2分)
(2)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位,如回到原位证明气密性良好。(2分)
一定时间内收集到的气体体积或收集一定体积的气体所需要的时间(2分)
本题解析:(1)比较铁盐和铜盐对H2O2分解的催化效果,就是观察产生气泡的快慢;硫酸铜和氯化铁的酸根离子不同,可能影响实验结果,故将酸根离子改成相同的,可以排除酸根对实验结果的影响,
(2)本装置中活塞是活动的,可通过其拉出与推入来改变装置内部的压强,前提关闭A处活塞。
该反应是通过生成气体的反应速率分析判断的,所以根据v=ΔV/Δt来判知,需要测量的数据是产生40ml气体所需要的时间
本题难度:一般
2、填空题 在下列事实中,什么因素影响了化学反应的速率??
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸______________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体__________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢__________________;
(6)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同_______________;
(7)夏天的食品易变霉,冬天就不易发生该现象__________________。
参考答案:(1)光
(2)反应物的接触面积
(3)在溶液中,水作溶剂,增大了接触面积
(4)催化剂
(5)反应物本身的性质
(6)反应物的浓度
(7)反应温度
本题解析:
本题难度:一般
3、选择题 恒温恒容条件下,能使

 正反应速率加快的是(?)
正反应速率加快的是(?)
A.减少C或D的物质的量
B.体积不变充入氦气使压强增大
C.减少B的物质的量
D.增大A或B的物质的量
参考答案:D
本题解析:此题考查浓度对反应速率的影响:增大反应物浓度,反应速率加快;题中要求加快正反应速率,即需要增大A或B的浓度,故D正确;
A项,减少C的物质的量,υ(逆)减小,υ(正)不变;减少D的物质的量无影响,因为D为固体,浓度不变;
B项,应体积不变,则A、B浓度不变,故速率不变;
减少B的物质的量,减慢正反应速率,故C错误;
本题难度:一般
4、选择题 下列说法正确的是 (?)
A.活化分子相互碰撞即可发生化学反应
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C.某一反应的活化分子百分率是个定值
D.浓度增大使得反应物分子中的活化分子百分率增大
参考答案:B
本题解析:活化分子发生“有效碰撞”可发生化学反应,故A错误;随着外界条件的变化,活化分子百分率会发生变化,如:升温活化分子数增多,则活化分子百分率增大;加催化剂,改变反应路径,降低反应的活化能,则活化分子百分率增大;故C错误;比如开始分子有100个,百分比是20%,那活化分子数是20,现在增加浓度,从100到200,活化分子数从20到40,但是百分比还是20%,故D错误;故选B。
本题难度:一般
5、选择题 一定量的锌粉和6 mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤
B.①③⑤
C.③④⑤
D.①③④