微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 红矾钠(重铬酸钠:Na2Cr2O7-2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛.
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO-Cr2O3)利用以下过程来制取.

①步骤I中反应的化学方程式为:
4FeO-Cr2O3(s)+8Na2CO3(s)+7O2?

?8Na2CrO4(s)+2Fe2O3(s)+8CO2;△H<0
该反应的化学平衡常数的表达式为______.
②图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
由图1判断,反应进行至t2min时,曲线发生变化的原因是______(用文字表达).
由图2判断,t2min到t3?min?的曲线变化的原因可能是______(填编号)
a.升高温度?b.加了催化剂?c.将原料粉碎?d.缩小容器体积

(2)步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外还含有铝、硅元素的化合物,它们的化学式可能是______、______.
①步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是______.
②步骤Ⅳ中发生反应的离子方程式为:______.
参考答案:(1)①根据平衡常数表达式=各个生成物平衡浓度的系数次方的乘积各个反应物平衡浓度系数次方的乘积,所以K=c(CO2)8c(O2)7,故答案为:K=c(CO2)8c(O2)7;
②由图1判断,反应进行至t2min时,二氧化碳的浓度均在原来基础上减小,氧气的浓度在原来基础上是增大的,说明平衡正向移动,可以是降低温度,故答案为:t2?时对平衡体系降温;由图2判断,t2min到t3?min?正逆反应速率加快并且仍相等,化学平衡不移动,则一定是加入了催化剂,故答案为:b;
(2)铬铁矿的主要成份为FeO?Cr2O3,还含有Al2O3、MgO、SiO2等杂质,当加入纯碱氧化的过程中,发生副反应:SiO2+Na2CO3?△?.?Na2SiO3+CO2↑、Al2O3+Na2CO3?△?.?2NaAlO2+CO2↑,故答案为:Na[A1(OH)4](或NaA1O2)、Na2SiO3;
①将溶液的pH调至7~8并煮沸,可以将[A1(OH)4]-(或A1O2-)、SiO32-等离子转化为沉淀而除去,故答案为:除去[A1(OH)4]-(或A1O2-)、SiO32-等杂质;
②CrO42-在酸性环境下可以转化为重铬酸根,即2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O.
本题解析:
本题难度:一般
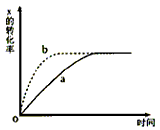
2、选择题 下图曲线a表示放热反应X(g)+Y(g)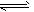 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
[? ]
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
参考答案:C
本题解析:
本题难度:一般
3、填空题 把在空气中久置的铝片5.0 g 投入盛有500 mL 0.5 mol ·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
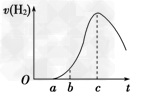
(1) 曲线由O →a段不产生氢气的原因是___________________________;有关反应的化学方程式为_________________ ;
(2) 曲线a→c段,产生氢气的速率增加较快的主要原因是____________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是____________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
参考答案:(1)硫酸首先和氧化铝反应,不产生H2;Al2O3+3H2SO4===Al2(SO4)3+3H2O
(2)反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
(3)硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
(4)不会
本题解析:
本题难度:一般
4、填空题 在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:
2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:
参考答案:
本题解析:
本题难度:一般
5、选择题 下列条件下的反应,放出H2最快的是
[? ]
金属(粉末状)/mol 酸的浓度和体积(mL) 反应温度
A. Mg 0.1 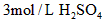 10 20℃
10 20℃
B. Al 0.1 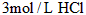 10 ? 20℃
10 ? 20℃
C. Zn 0.1 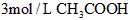 10 20℃
10 20℃
D. Fe 0.1  10 20℃
10 20℃
参考答案:A
本题解析:
本题难度:一般