微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 索尔维制碱法距今已有140多年的历史,为当时世界各国所采用,后被中国的侯氏制碱法取代.索尔维法的生产流程如下所示:
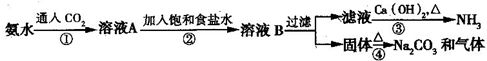
索尔维法能实现连续生产,但食盐的利用率只有70%,且副产品CaCl2没有合适的用途,会污染环境.
1940年我国化学家侯德榜先生经过多次试验,弥补了索尔维法的技术缺陷,加以改进,食盐利用率高达96%,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”.此方法的基本原理如下:
①向30~50℃的饱和食盐水中,先通入氨气至饱和,再通入CO2,从而得到碳酸氢钠沉淀.
②过滤,将滤渣加热而得产品.
③向滤液中加入细食盐末,调节温度为10~15℃,使NH4Cl沉淀,过滤,滤渣为NH4Cl产品,滤液为饱和食盐水.
请回答下列问题:
(1)写出向含氨气的饱和NaCl溶液中通入CO2 时发生反应的两个化学方程式:______.
(2)不能向饱和NaCl溶液中通入CO2 制NaHCO3的原因是______;也不能采用先向饱和NaCl溶液中通入CO2,再通入NH3的方法制NaHC03 的原因是______.
(3)写出在索尔维法生产过程中,生成CaCl2 的化学反应方程式为______.
(4)在侯氏制碱法中,______(填物质名称)可以循环利用.
(5)侯氏制碱法与索尔维法相比,其优点是______(任写一条即可).
2、简答题 实验室制备纯碱的主要步骤是:①将配制好的饱和NaCl溶液倒入烧杯中加热,控制温
度在30--35℃,搅拌下分批加入研细的NH4HC03固体,②加料完毕后,继续保温30分钟,③静置、过滤得NaHC03晶体.④用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧,制得Na2C03固体.
四种盐在不回温度下的溶解度(g/l00g水)表

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
39.8
NH4HCO3
11.9
15.8
21.0
27.0
-①
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
16.4
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.3
77.3
|
①>35℃NH4HC03会有分解
请回答:
(1)反应温度控制在30-35℃,是因为______;为控制此温度范围,采取的加热方法为______.
(2)加料完毕后,继续保温30分钟,目的是______;静置后只析出NaHCO3品体的原因是______.
(3)洗涤NaHC03晶体的操作是______.
(4)过滤所得的母液中含有的溶质______(以化学式表示).
(5)写出本实验中制备纯碱的有关化学方程式______.
(6)测试纯碱产品中NaHC03含量的方法是:准确称取纯碱样品W?g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c?(mol/L)的HCl溶液滴定至溶液由红色到无色,所用HCl溶液体积为V1?mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HC1溶液总体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______.
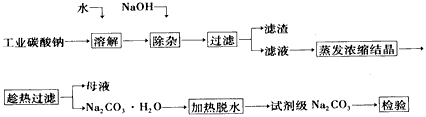
3、填空题 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+ 、Cl-和SO42-等杂质,提纯工艺路线如下:
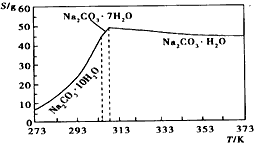
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为____。
(2)“趁热过滤”的原因是____。
(3)若在实验室进行“趁热过滤”,可采取的措施是____(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是____。
(5)已知:
Na2CO3·l0H2O(s)=Na2CO3(s) +10H2O(g) △H1= +532. 36kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s) +9H2O(g) △H2= +473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式__________________________________。
4、选择题 我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
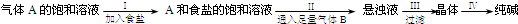
则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
5、简答题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3?
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
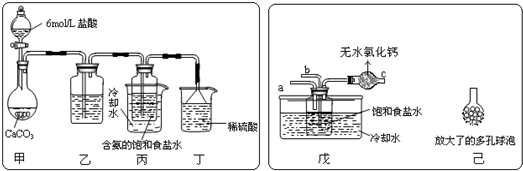
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3?晶体的操作是______(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从______管通入______?气体,再从______管中通入______气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:______.