微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下
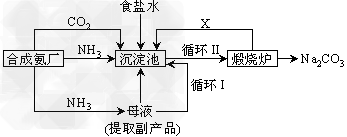
(1)?上述生产纯碱的方法称___________,副产品的一种用途为___________。
(2)?沉淀池中发生的化学反应方程式是______________________。
(3)?写出上述流程中X物质的分子式___________。 ?
(4)?使原料氯化钠的利用率从70%提高到90%以上,主要是设计了?___________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是______________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加___________。
(6)?向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
(a)?增大NH4+的浓度,使NH4Cl更多地析出 ?
(b)?使NaHCO3更多地析出
(c)?使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
参考答案:(1)联合制碱法或侯德榜制碱法;化肥或电解液或焊药等(其他合理答案均可)
(2)NH3+?CO2?+?H2O?+?NaCl?→?NH4Cl?+?NaHCO3↓ 或?NH3?+?CO2?+?H2O?→?NH4HCO3?、
NH4HCO3?+?NaCl?→?NaHCO3↓?+?NH4Cl
(3)CO2
(4)I;过滤
(5)稀硝酸和硝酸银溶液?
(6)?ac
本题解析:
本题难度:一般
2、填空题 工业生产纯碱的工艺流程示意图如下:
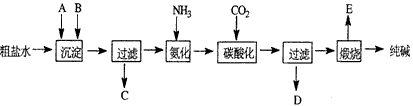
完成下列填空:
(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式。A__________________,B___________________。
(2)实验室提纯粗盐的实验操作依次为:取样、_______、沉淀、______、_______。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象_______________。碳酸化时没有析出碳酸钠晶体,其原因是__________________。
(4)碳酸化后过滤,滤液D最主要的成分是_________________(填写化学式),检验这一成分的阴离子的具体方法:____________________________。
(5)向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有__________________(填a、b、c字母) 。这样做使原料氯化钠的利用率从70%提高到90%以上,主要是设计了___________的循环,这就是有名的侯氏制碱法。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:_______________________(注明你的表达式中所用的有关符号的含义)。
参考答案:(1)Ca(OH)2或CaO;Na2CO3
(2)溶解;过滤;蒸发结晶;
(3)有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大
(4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子
(5)a;析出NH4Cl后的母液重新氨化
(6) (m1为加热前纯碱的质量,m2为加热后的质量)
(m1为加热前纯碱的质量,m2为加热后的质量)
本题解析:
本题难度:一般
3、简答题 某研究性学习小组学习了工业“侯氏制碱法”的原理后:
[提出问题]能否在实验室模拟“侯氏制碱法”中制取NaHCO3的过程呢?
[实验原理]写出候氏制碱法反应的化学方程式为______.[实验验证]如图是该学习小组进行模拟实验时所用到的部分主要装置.
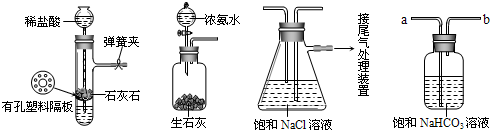
请回答下列问题:
(1)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若______,说明装置不漏气.
(2)D是连接在装置A与装置C之间的气体净化装置,进气口是______(填a或b),D的作用是除去______气体.可否将瓶内试剂换为碳酸钠溶液______(填“可”“否”).
(3)实验时先向饱和NaCl溶液中通入较多的______,再通入足量的______,其原因是______.(填写序号)
①使CO2更易被吸收?②NH3比CO2更易制取?③CO2的密度比NH3大
(4)用______的方法将生成的NaHCO3晶体从混合物中分离出来.
如果要制得纯碱,还需发生的反应是(写出反应的化学方程式):______.
[得出结论]利用“侯氏制碱法”在实验室可以制取NaHCO3.
参考答案:候氏制碱法是用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(1)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好;
故答案为:长颈漏斗中注入水,漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;
(2)气体从a管通入时才能使气体通过溶液而达到净化气体的目的;装置D内盛放的碳酸氢钠溶液能与混在气体中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去混在气体中的HCl;若换做碳酸钠溶液,二氧化碳也会被吸收;
故答案为:a;氯化氢(或HCl);否;
(3)先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收;
故答案为:NH3;CO2;①;
(4)通过过滤,可把混在溶液中的碳酸氢钠晶体分离出来;如果制得纯碱需要对碳酸氢钠固体加热分解得到,反应化学方程式为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑
故答案为:过滤.2NaHCO3?△?.?Na2CO3+H2O+CO2↑
本题解析:
本题难度:一般
4、填空题 绿色化学是20世纪90年代出现的一个多学科交叉的研究领域。它可以诠释为环境友好化学,其核心内涵是反应过程和化工生产中,尽量减少或彻底消除使用和生产有害物质。
(1)下列各项符合“绿色化学”要求的是__________。
A.处理废弃物 B.治理污染点 C.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为合理的是____。
A.企业有权自主选择厂址
B.应建在水资源丰富、交通方便且远离城市的郊区
C.建在西部干旱区可以脱贫致富
D.不宜建在人口稠密的居民区
(3)山东海化集团纯碱厂是世界上最大的氨碱法纯碱生产企业和亚太地区最大的纯碱出口基地,其主要生产流程如下:

①从理论上看,循环生产是否需要再补充NH3?___________________
②从原料充分利用的角度看,该方法有两个明显的缺陷,分别是:a_________;b___________。我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法(又叫联碱法),生产流程可简要表示如下:
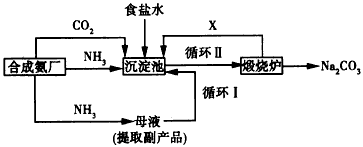
③该法与氨碱法的不同之处有两点,分别是:_________、_________
④从理论上看,每生产1 mol Na2CO3,需再补充的物质及其物质的量分别是_________。
参考答案:(1)C
(2)BD
(3)①不需要;②氯化钠未能充分利用;产生废弃物CaCl2;③将NH4Cl作为一种化工产品,生产流程不再产生可循环使用的氨气;将分离出NaHCO3和NH4Cl后含NaCl的溶液循环使用;④2mol NaCl、2 molNH3、
1 molCO2
本题解析:
本题难度:一般
5、简答题 纯碱(Na2CO3)在生产生活中具有广泛的用途.图1是实验室模拟制碱原理制取Na2CO3的流程图.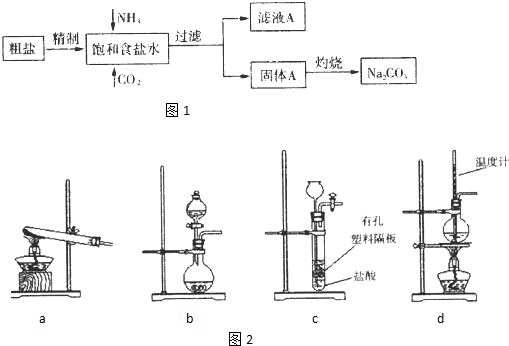
已知:向饱和食盐水中通入NH3、CO2后发生和反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等.
精制除杂的步骤顺序a→______→______→______→b(填字母编号).
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是______.
(2)灼烧固体A制Na2CO3在______(填字母序号)中进行.
a.坩埚b.蒸发皿c.烧杯d.锥形瓶
证明滤液A中含有NH4+的方法是______.
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3.使pH降低,反应的离子方程式______.
(3)图2装置中常用于实验室制备CO2的是______(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂______(填试剂名称).
(4)一种天然碱晶体成分是aNa2CO3?bNa2CO3?cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案.(仪器自选)请把实验方案填全:供选择的试剂:1mol?L-1H2SO4溶液、1.0mol?L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水.
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
参考答案:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2,
故答案为:c;d;e;NH3易溶于水,有利于吸收溶解度不大的CO2;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,
取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有
NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O,
故答案为:a;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3?H2O+CO32-+H2O;
(3)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体不加热
本题解析:
本题难度:一般