|
高考化学知识点总结《难溶电解质的溶解平衡》高频试题强化练习(2017年最新版)(八)
2017-03-03 00:14:56
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污
B.溶解镀锌层
C.去除铁锈
D.钝化
| (2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是________。
(3)由溶液B制取Fe3O4胶体粒子的过程中,须持续通入N2,其原因是
_______________________________________________________________
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离?__________(填“能”或“不能”),理由是________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________ g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒
⑤容量瓶?⑥胶头滴管 ⑦移液管
(6) 滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”、“偏小”或“不变”)。
参考答案:(1)AB
(2)抽滤、洗涤、灼烧
(3)N2气氛下,防止Fe2+被氧化
(4)不能 胶体粒子太小,抽滤时容易透过滤纸
(5)0.735 0 ③⑦
(6)偏大
本题解析:结合题目提供的信息及制备Fe3O4胶体粒子和ZnO的流程图,运用已有知识分析、解决问题。
(1)由于Zn的性质与Al的相似,可溶于NaOH溶液,因此用NaOH溶液处理废旧镀锌铁皮,除去表面的油污后,可将镀层锌溶解。
(2)调节溶液A的pH产生Zn(OH)2沉淀,然后过滤、洗涤、灼烧使Zn(OH)2分解为ZnO。考虑Zn(OH)2与Al(OH)3的性质相似,应为絮状沉淀物,过滤速度较慢,这里可采用抽滤,加快过滤速度。
(3)溶液B中含有Fe2+、Fe3+,加入NaOH溶液、加热,可得Fe3O4胶体粒子,其中
Fe2+极易被氧化成Fe3+,持续通入N2的目的是防止Fe2+被氧化。
(4)Fe3O4胶体粒子的直径较小,减压过滤时能透过滤纸,因此不能通过减压过滤实现固液分离。
(5)称取K2Cr2O7的质量为m(K2Cr2O7)=0.010 00 mol·L-1×0.250 0 L×294.0 g·mol-1=0.735 0 g。用固体配制溶液,要用电子天平称量固体质量,并在烧杯中溶解,然后转移到容量瓶中,不需要量取液体的量筒和移液管。
(6)若滴定前装有K2Cr2O7溶液的滴定管尖嘴部分有气泡,滴定结束时气泡消失,则滴定过程中读取K2Cr2O7溶液的体积偏大,测得Fe3O4中二价铁的含量偏大。
本题难度:困难
2、选择题 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
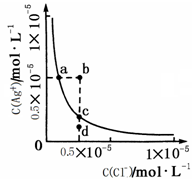
A.加入NaCl可以使溶液由a点变到b点
B.向AgCl饱和溶液中加入水, C(Ag+)增大
C.d点无AgCl沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:,AgCl在水中的沉淀溶解平衡方程式为: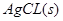 ? ?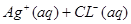 ,所以 ,所以
A错,加入NaCl,溶液中氯离子浓度增大,沉淀溶解平衡向逆反应方向移动,溶液中的银离子浓度减小;B错,饱和溶液中加入水,此时仍然是饱和溶液,溶液中各离子浓度不变;C正确;溶液中浓度积小于溶度积,处于不饱和状态;D错,溶度积受温度影响与其他因素无关;
本题难度:一般
3、选择题 常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0× 10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7 mol/L的KCl溶液混合,下列说法正确的是(溶液体积变化忽略不计)?(?)
A.不能确定有无AgI沉淀生成
B.没有AgI沉淀生成
C.有KNO3晶体析出
D.有AgI沉淀生成
参考答案:D
本题解析:混合后浓度分别为4.0×10-6mol/L和2.0×10-7 mol/L;Q=4.0×10-6mol/L×2.0×10-7 mol/L=8.0×10-13>Ksp;故有沉淀析出。
本题难度:一般
4、计算题 一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)  mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1.81/2="1.3?" 2751/3=6.5
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
参考答案:①AgCl(s) Ag+(a Ag+(a q)+Cl-(aq) q)+Cl-(aq)
 ?(1分) ?(1分)
Ag2CrO4(s)  2Ag+(aq)+CrO42-(aq) 2Ag+(aq)+CrO42-(aq)
2x? x
(2x)2·x=Ksp
 ?(1分) ?(1分)
∴ c(AgCl)<c(Ag2CrO4)?(1分)
②在0.010 mol·L-1 AgNO3溶液中,c(Ag+)="0.010" mol·L-1
AgCl(s)? ? Ag+(aq)?+? Cl-(aq) ? Ag+(aq)?+? Cl-(aq)
溶解平衡时:? 0.0 10+x? x 10+x? x
(0.010+x)·x=1.8×10-10?∵ x很小,∴ 0.010+x? ≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)= 1.8×10-8(mol·L-1)?(1分)
Ag2CrO4(s)? ? 2Ag+(aq)?+? CrO2-4(aq) ? 2Ag+(aq)?+? CrO2-4(aq)
溶解平衡时:? 0.010+x? ?x
(0.010+2x)2·x=1.1×10-12
∵ x很小,∴ 0.010+2x≈0.010
x=1.1×10-8(mol·L-1)?
∴ c(Ag2CrO4)=1.1×10-8 (mol·L-1)?(1分)
∴ c(AgCl)>c(Ag2CrO4)?(1分)
本题解析:略
本题难度:一般
5、选择题 某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
A.③>①>④>②
B.③>①>②>④
C.①>④>③>②
D.①>③>④>②
参考答案:A
本题解析:存在BaSO4(s)  Ba2+(aq)+SO Ba2+(aq)+SO (aq),②④由于c(SO (aq),②④由于c(SO )增大,抑制了BaSO4的溶解,使BaSO4溶解度降低,c(Ba2+)减小,但②中的c(SO )增大,抑制了BaSO4的溶解,使BaSO4溶解度降低,c(Ba2+)减小,但②中的c(SO )大于④中的,故c(Ba2+)大小应为③>①>④>②。 )大于④中的,故c(Ba2+)大小应为③>①>④>②。
本题难度:简单
|