微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题:
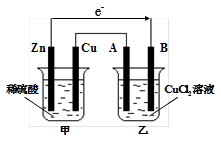
(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
参考答案:(1)负 Cu (2)CuCl2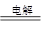 Cu+Cl2↑
Cu+Cl2↑
本题解析:(1)锌比铜活泼,且锌能和稀硫酸反应,所以甲装置是原电池,乙装置是电解池。其中锌是负极,B电极是阴极,溶液中的铜离子在阴极放电,生成单质铜。
(2)惰性电极电解氯化铜溶液的方程式是CuCl2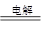 Cu+Cl2↑。
Cu+Cl2↑。
考点:考查原电池、电解池的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。试题紧扣教材,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
2、选择题 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是
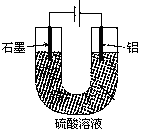
A.阳极电极方程式为: Al—3e—+6OH—=Al2O3+H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
参考答案:C
本题解析:A、电解质为硫酸溶液,OH?不可能参加反应,错误;B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O  Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2×0.15mol=0.3mol,阳极反应为:根据差量法进行计算:设阳极增重的质量为x,
Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2×0.15mol=0.3mol,阳极反应为:根据差量法进行计算:设阳极增重的质量为x,
2Al+3H2O-6e?=Al2O3+6H+?m
6mol? 48g
0.3mol? x
6mol:0.3mol=48g:x,解得x=2.4g,即阳极增重2.4g,正确;D、根据电流的方向可知,阳离子移向阴极,所以H+移向石墨电极,错误。
本题难度:一般
3、选择题 下列描述中不符合生产实际的是
A:电解熔融Al2O3制金属铝,用铁作阳极
B:电解法精炼粗铜,用纯铜作阴极
C:电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D:在镀件上镀锌,用锌用阳极,硫酸锌作电解质溶液
参考答案:A
本题解析:A、电解熔融Al2O3制金属铝,用铁作阳极,则铁失去电子,氧离子不能放电,不符合工业生产实际,应该用惰性电极做阳极,A符合题意;B、电解法精炼粗铜,用纯铜作阴极,粗铜做阳极,硫酸铜溶液做电解液,正确,B不符合题意;C、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极,正确,C不符合题意;D、在镀件上镀锌,用锌用阳极,镀件作阴极,硫酸锌作电解质溶液,正确,D不符合题意,答案选A。
本题难度:一般
4、选择题 已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2+?+?2[Fe(CN)6]3-===?Fe3[Fe(CN)6]2↓。现用下图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出蓝色的字“神奇的化学”,据此判断下列说法正确的是
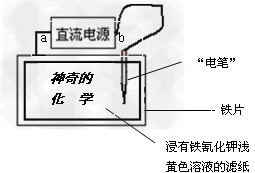
[?]
A.直流电源的a极是阴极
B.直流电源的b极是负极
C.阳极反应为:[Fe(CN)6]3-+?e-==Fe2+?+6CN-
D.“电笔”笔尖材料是铁,其电极反应为:Fe-2e-===Fe2+?
参考答案:D
本题解析:
本题难度:一般
5、实验题 (12分) 如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。
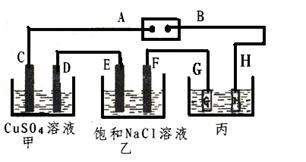
试回答以下问题:
(1)电极A的名称是?。
(2)甲装置中D电极的电极反应式:? ______________________________?。
(3) 在25℃时若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=________??。
(4)欲用丙装置给铜镀银,G应该是?____?(填“银”或“铜”),?电镀液的主要成分是(填化学式)?。
参考答案: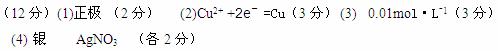
本题解析:略
本题难度:一般