|
高中化学知识点归纳《电解池原理》试题特训(2017年最新版)(六)
2017-03-03 00:20:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于如图电解池工作时的相关叙述正确的是( )
A.Fe电极作阳极,发生氧化反应
B.C1-向石墨极作定向运动
C.石墨电极反应:Fe3++3e-═Fe
D.电解池发生总反应:2Cl-+2Fe3+ Cl2+2Fe2+
| 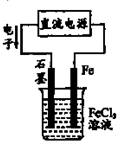
参考答案:A、电子流出的一极是电源的负极,故Fe连接电源的正极,为阳极,发生氧化反应,故A正确;
B、电解质溶液中,阴离子向阳极移动,Fe连接电源的正极,为阳极,故C1-向Fe极作定向运,故B错误
C、石墨是电解池的阴极,发生还原反应,电极反应为:Fe3++e-═Fe2+,故C错误;
D、Fe连接电源的正极,为阳极,是活性电极,Fe反应氧化反应生成Fe2+,石墨是电解池的阴极,发生还原反应,Fe3+放电生成Fe2+,故电解池发生总反应:Fe+2Fe3+?电解?.?3Fe2+,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 下列有关电解池说法不正确的是( )
A.电解池是将电能转化为化学能的装置
B.与电源正极相连的是电解池的阴极
C.与电源负极相连的是电解池的阴极
D.在电解池中阳极发生氧化反应
参考答案:B
本题解析:依据电解的原理及电解池的有关知识很易得出答案。
本题难度:简单
3、简答题 工业上用饱和电解食盐水来制取氯气.现取500mL含NaCl为11.7g的饱和食盐水进行电解.(已知2NaCl+2H2O═2NaOH+H2↑+Cl2↑)
(1)在标准状况下制得Cl2多少升?
(2)所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
参考答案:(1)根据题意,NaCl物质的量n=nM=11.7g58.5g/mol=0.2mol,
设电解过程生成氯气的物质的量为y,生成氢氧化钠的物质的量为x,
2NaCl+2H2O??通电?.??2NaOH+H2↑+Cl2↑
2? ?2? 1
0.2mol?x?y
22=0.2molx、21=0.2moly,
解得x=0.2mol、y=0.1mol,
所以在标准状况下制得Cl2体积V=nVm=0.1mol×22.4L/mol=2.24L,
答:在标准状况下制得Cl222.4L;
(2)据c=nV=0.2mol0.5L=0.4 mol/L,
答:所得NaOH的物质的量浓度为0.4 mol/L.
本题解析:
本题难度:一般
4、选择题 下列实验“操作和现象”与“结论”对应关系正确的是
[? ]
操作和现象
结论
A.
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解
溶解度: S(CaCO3)<S(CaSO4)
B.
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成
该电极为阳极
C.
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出
氧化性:Cu2+>Fe3+
D.
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
该溶液中一定含有Ag+
参考答案:A
本题解析:
本题难度:一般
5、选择题 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是(? )
A.原混合溶液中c(K+)为1 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
参考答案:B
本题解析:电解KNO3和Cu(NO3)2的混合溶液,在阳极发生反应:4OH—-4e-=2H2O+O2↑。n(O2)= 22.4 L÷22.4L/mol=1mol。则转移电子4mol.因此选项B正确;在阴极首先发生反应:Cu2++2e-=Cu,然后发生:2H++2e-=H2↑。由于产生氢气的物质的量是1mol,得到电子2mol,则产生Cu转移的电子也是2mol,产生Cu1mol。所以选项C错误;Cu(NO3)2的物质的量是1mol,根据N守恒可得n(KNO3)= 6.0 mol/L×0.5L-2mol=1mol,所以c(K+)= c(KNO3)=1mol÷0.5L=2mol/L,选项A错误;因为在反应过程中放电的OH-的物质的量与H+及电子的物质的量相等,因为电子转移4mol,所以电解后溶液中H+的物质的量也是4mol,所以c(H+)=4mol÷0.5L=8mol/L ,所以选项D错误。
本题难度:一般
|
