微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
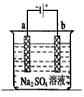
1、选择题 如图为直流电源电解释Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是
[? ]
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
参考答案:D
本题解析:
本题难度:一般
2、选择题 将含有0.4 mol CuSO4和0.2 mol KCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上析出19.2 g Cu,此时在另一电极上放出的气体在标准状况下的体积为(忽略水中溶解)
A.3.36 L
B.4.48 L
C.5.60 L
D.6.72 L
参考答案:B
本题解析:阴极:Cu2+ +2e-===Cu,由题得到0.3mol Cu。则得电子0.6mol。
阳极:2Cl- -2e-==Cl2。溶液中只有0.2molCl-,则只有0.1molCl2生成,失电子0.2mol。由得失电子守恒可知,则剩下0.4mol电子,由电解水失去。电极方程式:2H2O- 4e-==O2+4H+。得0.4mol电子,生成0.1molO2,0.4molH+。则电极上析出的气体:0.1molCl2+0.1molO2=0.2mol。在标准状况下的体积:4.48L。
故选B
点评:在进行电化学的相关计算时要注意准确判断电极反应,考虑电子守恒。
本题难度:一般
3、填空题 废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:

(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为________________________________________________________________________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是____________________________________________。
(4)将Co2O3还原成Co粉的化学反应方程式为____________________。
参考答案:(1)2H++2e-=H2↑ (2)Fe(OH)3 Co2+(或Co)
(3)NH4Cl 焙烧时NH4Cl分解产生NH3和HCl
(4)Co2O3+3H2=2Co+3H2O
本题解析:本题考查电解原理、除杂、洗涤沉淀、氧化还原反应方程式的书写,意在考查考生对化工流程的分析能力和综合运用知识的能力。(1)阴极发生还原反应,应是H+放电生成氢气。(2)将废旧刀具电解时阳极产生Co2+和Fe2+,加入双氧水后Fe2+被氧化生成Fe3+,通入氨气后生成Fe(OH)3沉淀,即滤饼的主要成分是Fe(OH)3。洗涤液中含有Co2+,可循环使用。(3)加入的草酸铵与CoCl2反应,生成草酸钴和氯化铵,则溶液Ⅰ中主要含有NH4Cl。若草酸钴表面的NH4Cl未洗净,则焙烧时NH4Cl分解产生NH3和HCl,造成环境污染。(4)方程式为Co2O3+3H2=2Co+3H2O。
本题难度:一般
4、填空题 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子
| Ag+、Na+
|
阴离子
| NO3—、SO42—、Cl-
|
下图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27 g。常温下各烧杯中溶液的pH与电解时间t的关系如下图Ⅱ所示。据此回答下列问题:
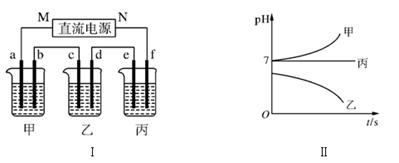
(1)M为电源的________(填“正”或“负”)极,A是________(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:________。
(3)写出乙烧杯的电解池反应:________________________________________________。
(4)要使丙恢复到原来的状态,应加入________ g ________(填写化学式)。
参考答案:(12分,每空2分)
(1)负NaCl
(2)1.4 L
(3)4AgNO3+2H2O 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(4)2.25 H2O
本题解析:接通电源,经过一段时间后,测得乙中c电极质量增加了27 g,说明乙中含有金属阳离子,则乙中溶质是硝酸银,Ag++e-===Ag,得到27 g Ag,物质的量是27g/108g/mol=0.25mol,电路中通过的电子是0.25 mol。结合图Ⅱ,可知甲中溶液的pH增大是氯化钠,丙的pH不变是硫酸钠。
(1)c电极的质量增加,说明c电极有Ag析出,则c是阴极,b是阳极,a是阴极,所以M是电源的负极,甲中的溶液是NaCl溶液,产生的氢氧化钠使溶液pH增大;
(2)丙是硫酸钠,N是电源的正极,则f是阳极,阳极产生的气体是氧气,根据以上分析,转移0.25 mol电子产生0.25mol/4="0.0625" mol O2,标准状况下的体积是0.0625mol×22.4L/mol=1.4L;
(3)乙是硝酸银溶液,电解硝酸银溶液得到的产物是Ag、氧气和硝酸,化学方程式为4AgNO3+2H2O 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(4)丙是硫酸钠溶液,电解硫酸钠溶液实质是电解水,根据(1)的计算结果,阳极产生0.0625mol氧气,阴极则产生0.125mol氢气,相当于电解0.125mol水,所以要使丙恢复到原来的状态,应加入0.125mol×18g/mol=2.25g的H2O。
考点:考查电解反应原理的应用,电解质溶液的判断,电源正负极的判断,氧化还原反应的计算
本题难度:一般
5、填空题 (14分)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ==="4LiCl" +S +SO2
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是______________________.
(5)用此电池电解(电极均为惰性电极)起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
参考答案:(1)锂 Li-e-===Li+,
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)SOCl2+H2O===SO2↑+2HCl↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
(5)氧化铜(或碳酸铜) 8g(或12.4g)
本题解析:(1)根据电池总反应,Li发生氧化反应,所以电池负极材料为Li,负极反应为Li-e-===Li+;(2)正极反应=电池的总反应—负极反应,正极反应为2SOCl2+4e-===4Cl-+S+SO2;(3)NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成,所以把少量水滴到SOCl2中,应该生成二氧化硫和氯化氢,化学方程式为SOCl2+H2O===SO2↑+2HCl↑;(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行;(5)电解硫酸铜溶液的总反应为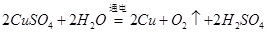 ,后溶液的c(H+)增加0.1mol/L,即生成硫酸0.1mol,生成铜0.1mol、。氧气0.05 mol,所以需要加入氧化铜8g或碳酸铜12.4g
,后溶液的c(H+)增加0.1mol/L,即生成硫酸0.1mol,生成铜0.1mol、。氧气0.05 mol,所以需要加入氧化铜8g或碳酸铜12.4g
考点:本题考查原电池原理。
本题难度:困难