微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)按图所示装置,以石墨为电极电解氯化铜溶液。
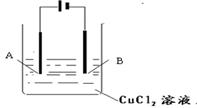
(1)阴极为?(“A”或“B”),阴极电极反应式??
(2)如要用电解的方法精炼铜,电解液选用CuSO4溶液,则阳极的材料是?(填写“粗铜”或“纯铜”)?
阳极电极反应式为(不写杂质 的)?。
的)?。
参考答案: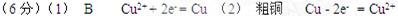
本题解析:略
本题难度:一般
2、选择题 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时间不变色。下列说法中正确的是
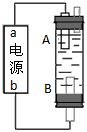
[? ]
A.电源中a为负极,b为正极
B.电解池中的电解液不可以是NaCl溶液
C.B电极发生的反应:2H2O+2e-=H2↑+2OH-
D.A、B两端都必须使用铁作电极
参考答案:C
本题解析:
本题难度:一般
3、选择题 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
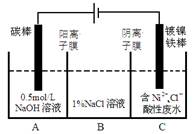
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
参考答案:B
本题解析:由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH- -4e-=2H2O+O2↑,镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e- = Ni。电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大。又因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH 。若将图中阳离子膜去掉,由于放电顺序Cl-> OH-,则Cl-移向阳极放电:2Cl-- -2e-= Cl2↑,电解反应总方程式会发生改变。故B错误选B。
本题难度:一般
4、选择题 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
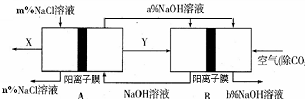
下列说法正确的是
A.X为H2,Y为Cl2
B.A池为电解池,且m<n
C.B池为燃料电池,且a<b
D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
参考答案:CD
本题解析:A池为电解池,B为燃料电池,燃料电池的工作原理为:燃料进入负极、空气(氧气)进入正极;
A错,X为Cl2,Y为H2;B错,在电解氯化钠溶液时,氯离子不断放电生成氯气,使溶液中氯离子浓度减小,所以A池为电解池,且n<m;C正确,在氢氧燃料电池中,工作时不断生成水,使溶液中氢氧化钠的浓度减小,即B池为燃料电池,且a<b;D正确;
本题难度:一般
5、填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g?5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10. 47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_________极;
②电极b上发生的电极反应为______________________;
③列式计算电极b上生成的气体在标准状况下的体积:_____________________
④电极c的质量变化是______________________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液________________________
乙溶液________________________
丙溶液________________________
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
_______________________________?
参考答案:(1)①正;②4OH--4e-==2H2O+O2;③水减少的质量: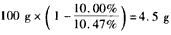 ,生成O2体积:
,生成O2体积:
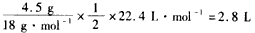 ;④16;
;④16;
⑤甲溶液:碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大
乙溶液:酸性增大,因为阳极上OH-生成O2,溶液中H+离子浓度增加
丙溶液:酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
本题解析:
本题难度:困难