| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题预测(2017年最新版)(十)
参考答案:B 本题解析:A.NaCN和NaClO溶液相比,前者的pH较大,可以得出酸性HCN<HClO,错误;B、同浓度的HCN和HClO,酸性HCN<HClO,所以次氯酸的电离程度大于氢氰酸,即c(CN-)<c(ClO-),正确;C、酸性HCN<HClO,同体积和同浓度的HCN和HClO的pH大小顺序是:HClO<HCN,错误;D、同体积和同浓度的HCN和HClO,其物质的量是相等的,与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO=HCN,错误;选B。 本题难度:一般 2、填空题 (12分)Ⅰ.(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 ________(填“促进”、“抑制”)其水解。 参考答案:Ⅰ.(1)酸,< ,Ag++H2O 本题解析:Ⅰ.(1)AgNO3是强酸弱碱盐,弱碱根离子水解消耗水电离产生的OH-,使盐的水溶液呈酸性。常温时的pH<7。水解的两种方程式是Ag++H2O 本题难度:困难 3、选择题 H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是 |
参考答案:A
本题解析:NaHSO3溶液呈酸性,表明HSO3-的电离程度大于水解程度,但是电离和水解都比较微弱,所以A对;B项结合物料守恒,应该为c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3);C项应为c(Na+)>c(HSO3-) > c(H+) > c(OH-);结合电荷守恒可知D项错误,应为c(Na+) + c(H+) = c(HSO3-) + c(OH-) +2 c(SO32-).
考点:离子浓度大小的比较。
本题难度:一般
4、选择题 下列表示物质变化的化学用语正确的是
[? ]
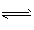 2H++CO32-
2H++CO32- Fe(OH)3+3H+
Fe(OH)3+3H+ H3O++S2-
H3O++S2-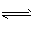 Al(OH)3+3H2S
Al(OH)3+3H2S 参考答案:B
本题解析:
本题难度:简单
5、选择题 在25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH4HCO3的溶液中,测得其NH4+浓度分别为a、b、c、d(单位为mol/L),下列判断正确的是(相同条件下氨水和醋酸的电离程度相同)
A.a=b=c=d
B.a=c>b=d
C.c>a>d>b
D.c>a>b>d
参考答案:D
本题解析:
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学必考知识点《化学基本概.. | ||