| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题预测(2017年最新版)(八)
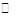 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。(4)测得25℃时,CaA的Ksp为2.0×10-11。常温下将10gCaA固体投入110mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.08 mol·L-1,则溶液中c(A2-)= 。 参考答案:(1)酸 HA-只电离不水解 (2)B 本题解析:(1)由于H2A===H++HA-,所以HA-只电离不水解,故溶液呈酸性;(2) )某温度下溶液呈中性,PH不一定为7;溶液呈中性c(OH-)=" c" (H+),所以水的离子积Kw=c2(OH-);10 mL 0.1 mol·L-1 NaHA溶液中加入10 mL 0.1 mol·L-1 KOH溶液,恰好完全反应生成Na2A,由于A2—水解,溶液呈碱性,要使溶液呈中性,加入氢氧化钾的体积小于10mL;所以c(K+) <c(Na+),故B正确;(3) A2-+H+ 本题难度:一般 3、填空题 (12分)(1)要除去MgCl2酸性溶液里少量的Fe3+,可选用的试剂是 (填序号) 。 |
参考答案:(1)ABD (2) 2×10-7 mol/L (3)8×10-9 mol/L
本题解析:(1)根据FeCl3的水解:FeCl3+3H2O Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去,又不会引入新杂质。(2)纯水中 C(OH-) = C(H+) = 2×10-7 mol/L,Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14,稀盐酸中 C(OH-) ="Kw/" C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L。(3)纯水
Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去,又不会引入新杂质。(2)纯水中 C(OH-) = C(H+) = 2×10-7 mol/L,Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14,稀盐酸中 C(OH-) ="Kw/" C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L。(3)纯水 说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,解得x:y=2:9,
说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,解得x:y=2:9,
考点:考查物质的分离提纯,酸碱混合时的定性判断及有关ph的计算。
本题难度:一般
4、选择题 下列关于盐类的水解反应与中和反应的说法中,正确的是 ( )。
A.二者是同一反应
B.两者没有任何联系
C.盐类水解反应的逆反应是中和反应
D.两者互为可逆反应
参考答案:C
本题解析:水解反应可以看作是中和反应的逆反应,所以选项C正确,答案选C。
本题难度:一般
5、选择题 能使Na2CO3溶液中Na+与CO32-更接近2∶1的措施是
A.加水
B.加Na2CO3粉末
C.加KOH固体
D.加热
参考答案:C
本题解析:
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学必考知识点《化学基本概.. | ||