微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是
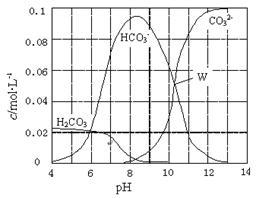
A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32?-)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32?-)>c(HCO3-)>c(H2CO3)
参考答案:B
本题解析:试题分析:根据电荷守恒可知,溶液中离子应该满足关系式c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) + c(HCO3-),A不正确;pH=4,说明反应中一点有CO2生成,所以根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)<0.1 mol·L-1,B正确;根据图像可知pH=8时,溶液中碳酸氢钠的远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知c(H2CO3)+ c(HCO3-)+ c(CO32?-)=c(Cl-)=1/2 c(Na+),则c(H+)+ 2c(H2CO3)+ 2c(HCO3-) = c(OH-)+c(Cl-),C不正确;根据图像可知pH=11时,溶液碳酸钠的浓度远远大于碳酸氢钠的浓度,这说明碳酸钠是过量的,则c(Na+)>c(CO32?-) >c(Cl-)>c(HCO3-)>c(H2CO3),D不正确,答案选B。
考点:考查碳酸钠和盐酸反应中离子浓度大小比较
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图像和题意灵活运用即可。
本题难度:一般
2、选择题 A+、B+、C+、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液PH=7,BC盐溶液PH>7,则下列说法正确的是
A.AD盐溶液PH<7
B.在AC盐溶液中C(A+)+C(AOH)=C(C-)+C(HC)
C.碱的电离程度一定是:AOH>BOH
D.酸的电离程度一定是:HD>HC
参考答案:C
本题解析:
本题难度:困难
3、选择题 等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,溶液中离子浓度关系不正确的是
A.c(M+)=c(HA)+c(A-) B.c(M+)>c(H+)>c(A-)>c(OH-)
C.c(OH-)=c(H+)+ c(HA) D.c(M+)+c(H+) =c(OH-)+c(A-)
参考答案:B
本题解析:等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,生成强碱弱酸盐MA,由于强碱弱酸盐MA中弱酸根的水解,溶液呈碱性;A、由元素守恒得c(M+)=c(HA)+c(A-),A正确;B、离子浓度大小关系为c(M+)> c(A-)> c(H+)>c(OH-),B错误;C、由质子守恒得c(OH-)=c(H+)+ c(HA),C正确;D、由电荷守恒得c(M+)+c(H+) =c(OH-)+c(A-),D正确;答案选B。
考点:盐的水解
本题难度:一般
4、选择题 为了使硫化钠溶液中的c(Na+)≈2c(S2-),应该对硫化钠溶液采取的措施是
A.加入少量盐酸
B.加入少量氢氧化钾
C.加入少量氯化铜
D.升高温度
参考答案:B
本题解析:
本题难度:一般
5、选择题 把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
A.CH3COOH溶液
B.NaCl溶液
C.NaOH溶液
D.FeCl3溶液
参考答案:B
本题解析:稀释过程中溶液中每种离子的浓度都不会增加说明不会水解(无弱离子)也不是酸和碱,是强酸强碱盐.
本题难度:困难