|
高考化学试题《原电池原理》高频试题强化练习(2017年最新版)(六)
2017-03-03 00:33:38
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示,a、b是两根石墨棒.下列叙述正确的是( )
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.稀硫酸中硫酸根离子的物质的量不变
D.往滤纸上滴加酚酞试液,a极附近颜色变红
|

参考答案:左边装置能自发的进行氧化还原反应,属于原电池,右边是电解池,锌易失电子作负极,铜作正极,则a是阳极,b是阴极,
A.a是阳极,阳极上失电子发生氧化反应,故A错误;
B.b是阴极,阴极上得电子发生还原反应,故B错误;
C.左边装置中,负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气,所以硫酸根离子不参加反应,则其物质的量不变,故C正确;
D.a电极上氯离子放电生成氯气,b电极上氢离子放电生成氢气,同时b电极附近还生成氢氧根离子,导致碱性增强,所以b极附近颜色变化,故D错误;
故选:C.
本题解析:
本题难度:一般
2、选择题 已知反应AsO43- +2I- +2H+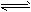 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2 均为石墨电极),分别进行下述操作: AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2 均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液结果发现电流计指针均发生偏转。
据此,下列判断正确的是
[? ]
A.操作I过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作I过程中,C2棒上发生的反应为:AsO43-+2H+ +2e-=AsO33-+H2O
D.操作Ⅱ过程中,C1棒上发生的反应为:2I- =I2 +2e-
参考答案:C
本题解析:
本题难度:一般
3、选择题 一个化学电池的总反应方程式为:Zn+Cu2+==Zn2++Cu,该化学电池的组成可能为( )
| A
| B
| C
| D
| 正极
| Cu
| Mg
| Zn
| Fe
| 负极
| Zn
| Zn
| Cu
| Zn
| 电解质溶液
| H2SO4
| CuSO4
| ZnCl2
| CuCl2
|
参考答案:D
本题解析:考查原电池的构成,构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中。根据方程式可知,锌失去电子,所以作负极。铜离子得到电子,因此电解质溶液中必须含有铜离子,答案选D。
本题难度:一般
4、填空题 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成.请回答下列问题:
(1)请写出B极板的名称:______?电极反应式______
写出电解时反应的总离子方程式______
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.电解后溶液的pH为______;要使电解后溶液恢复到电解前的状态,则需加入______,其质量为______g.(假设电解前后溶液的体积不变)
(3)若原溶液为1L?K2SO4、CuSO4的混合溶液,且c(SO42-)=2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解.则原溶液中的c(K+)=______.
参考答案:(1)电解硫酸盐时,溶液中氢氧根离子放电能力大于硫酸根离子,所以在阳极上析出氧气,根据实验现象判断,在阴极上析出铜,所以B极是阳极;阳极上氢氧根离子失电子生成水和氧气,电极反应式为 4OH--4e-=2H2O+O2↑;根据实验现象知,溶液中铜离子得电子变成铜单质析出,氢氧根离子失电子变成水和氧气,所以其电池反应式为
?2Cu2++2H2O?电解?.?2Cu+O2↑+4H+;
故答案为:阳极; 4OH--4e-=2H2O+O2↑; 2Cu2++2H2O?电解?.?2Cu+O2↑+4H+.
(2)2Cu2++2H2O?电解?.?2Cu+O2↑+4H+?
? 128g?4mol?
? 1.6g?0.05mol
C(H + )=nV=0.05mol0.5L=0.1mol/L
所以pH=1;
根据电池反应式知,析出的物质是铜和氧气,要使电解后溶液恢复到电解前的状态,则需加入?CuO;
2Cu2++2H2O?电解?.?2Cu+O2↑+4H+?
? 128g 32g
? 1.6g? 0.4g
所以加入的质量=铜的质量+氧气的质量=1.6g+0.4g=2g
故答案为:pH=1;CuO;2.
(3)电解时阳极上析出氧气,阴极上析出氢气和铜,22.4L气体的物质的量为1mol,根据电解时阴阳极上得失电子守恒,列关系式为:n(H2)×2+n(Cu)×2=n(O2)×4,
1mol×2+n(Cu)×2=1mol×4,
n(Cu)=1mol
C(Cu 2+ )=1mol1L=1mol/L
根据溶液中阴阳离子的电荷守恒列关系式为:C(Cu 2+ )×2+c(K+)×1=c(SO42-)×2
所以c(K+)=2mol/L?
故答案为:2mol/L.
本题解析:
本题难度:一般
5、选择题 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是?
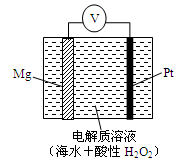
A.电池的负极反应为:Mg – 2e-= Mg2+
B.电池的正极产生的还原产物是水
C.电池工作时,H+向负极移动
D.电池工作一段时间后,溶液的pH增大
参考答案:C
本题解析:A.该燃料电池中,镁作负极,负极上镁失电子发生氧化反应,电极反应式为:Mg-2e-=Mg2+,正确;B.铂作正极,正极上双氧水得电子发生还原反应而生成水,正确;C.原电池放电时,电解质溶液中阳离子向正极移动,所以氢离子向正极移动,错误;D.原电池正极上双氧水得电子结合H+生成水,溶液中氢离子浓度降低,所以溶液的pH增大,正确,答案选C。
本题难度:一般
| 