微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
[? ]
A.增大
B.减小
C.不变?
D.可能增大,也可能减小
参考答案:D
本题解析:
本题难度:简单
2、填空题 (12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)?②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在?种粒子,且c(HX)?c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-)?0.1 mol/L(忽略体积变化)。
(3)上述混合液显?性(填“酸”、“碱”或“中”),其原因用离子方程式表示为?。
参考答案:(1) < ;? (2)? 6 ,<?, = ; (3 ) 碱 , X-+H2O  ?HX+OH-
?HX+OH-
本题解析:略
本题难度:简单
3、选择题 氢氟酸为弱酸。250C时将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是
①n(H+);②c(H+)·c(OH—);③c(OH—)+ c(F—);④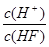 ;⑤
;⑤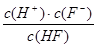 ;
;
A.①③④
B.②③④
C.③④⑤
D.②⑤
参考答案:D
本题解析:①n(H+)随着加水的量会逐渐的增大,因为弱电解质的电离会随浓度的减小而增大; ②c(H+)·c(OH—)这是水的离子积常数,只随温度的变化而变化;③c(OH—)+ c(F—),依据电花守恒可知c(OH—)+ c(F—)=c(H+),但是氢离子的浓度是一直在变化的,所以这个值是个变化的值;④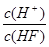 ?无法确定;⑤
?无法确定;⑤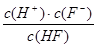 这是平衡常数,是个定值;因此选D。
这是平衡常数,是个定值;因此选D。
本题难度:一般
4、选择题 下列说法正确的是( )
A.相同温度下,若弱酸HA的电离常数大于弱酸HB的电离常数,则同浓度钠盐溶液的碱性:NaA<NaB
B.用广泛pH试纸测得0.10mol?L-1NH4Cl溶液的pH=5.2
C.盐酸是强电解质,醋酸是弱电解质,所以盐酸的导电性一定会强于醋酸溶液
D.将碳酸钾溶液蒸干,得到的固体物质是氢氧化钾
参考答案:A.酸的电离常数越大,酸性越强,对应的钠盐溶液中酸根离子的水解程度越小,溶液pH越小,故A正确;
B.广泛pH试纸精确到1,可测量的值为5,故B错误;
C.盐酸为混合物,不是电解质,且溶液的导电性与离子浓度大小有关,与电解质的强弱无关,因二者的浓度未知,不能用于比较酸性的强弱,故C错误;
D.碳酸钾溶液蒸干,在加热过程中促进水解,溶液碱性增强,但最终仍得到碳酸钾,氢氧化钾不能稳定存在于空气中,故D错误.
故选A.
本题解析:
本题难度:一般
5、选择题 相同条件下,现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是(?)
A.由水电离出的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:③>②
C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大
D.向溶液中加入100mL水后,溶液的pH:③>④>①>②
参考答案:A
本题解析:A. H2O H++OH-.这几种物质电离产生的c(H+)或c(OH-)相等,所以对水电离的抑制程度相同。因此由水电离出的c(H+)也相等。即:①=②=③=④。正确。B.将②HCl是一元强酸,完全电离;而③则是一元弱碱,电离产生的离子的浓度相等,则c(HCl)<c(NH3·H2O).若溶液混合后,pH=7,则消耗溶液的体积:②>③。错误。C.一元HCl是强酸。完全电离。醋酸是弱酸,部分电离,当溶液等体积时,由于醋酸的物质的量多,所以产生的氢气比盐酸多。NaOH与Al反应放出氢气的方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;盐酸与Al反应的方程式为:2Al+6HCl=2AlCl3+3H2↑。当HCl与NaOH溶液的物质的量相等时,NaOH放出的氢气也比HCl多。因此三种溶液分别与足量铝粉反应,②生成的H2的物质的量最小。错误。D.向溶液中加入100mL水后,对溶液进行稀释,由于在弱酸、弱碱溶液中存在电离平衡,未电离的电解质分子会继续电离产生H+或OH-,因此强酸、强碱溶液的pH变化要比弱酸、弱碱的大。实验稀释相同的倍数后溶液的pH:③>④>②>①。错误。
H++OH-.这几种物质电离产生的c(H+)或c(OH-)相等,所以对水电离的抑制程度相同。因此由水电离出的c(H+)也相等。即:①=②=③=④。正确。B.将②HCl是一元强酸,完全电离;而③则是一元弱碱,电离产生的离子的浓度相等,则c(HCl)<c(NH3·H2O).若溶液混合后,pH=7,则消耗溶液的体积:②>③。错误。C.一元HCl是强酸。完全电离。醋酸是弱酸,部分电离,当溶液等体积时,由于醋酸的物质的量多,所以产生的氢气比盐酸多。NaOH与Al反应放出氢气的方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;盐酸与Al反应的方程式为:2Al+6HCl=2AlCl3+3H2↑。当HCl与NaOH溶液的物质的量相等时,NaOH放出的氢气也比HCl多。因此三种溶液分别与足量铝粉反应,②生成的H2的物质的量最小。错误。D.向溶液中加入100mL水后,对溶液进行稀释,由于在弱酸、弱碱溶液中存在电离平衡,未电离的电解质分子会继续电离产生H+或OH-,因此强酸、强碱溶液的pH变化要比弱酸、弱碱的大。实验稀释相同的倍数后溶液的pH:③>④>②>①。错误。
本题难度:一般