微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )。
4NO(g)+6H2O(g),下列叙述正确的是( )。
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡
参考答案:A
本题解析:NH3和O2的转化量之比等于其化学计量数之比,若二者的起始投料之比等于其化学计量数之比,则它们的转化率相等。
本题难度:一般
2、选择题 相同温度下体积固定的密闭容器中,发生如下可逆反应: A2(g) + 3B2(g) 2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是
2AB3(g),下列情况一定能说明该可逆反应已经达到化学平衡状态的是
①反应中各组分的物质的量不随时间而变化了②混合气体的总物质的量不随时间而变化了③容器内的压强不随时间而变化了⒁④容器内气体的平均相对分子质量不随时间而变化了⑤容器内气体的密度不随时间而变化了⑥V(A2) 正/v(B2) 正="1/3" ⑦V(A2) 正/v(B2) 逆="1/3" ⑧c(A2):c(B2):c(AB3)=1:3:2⑨ c(A2)=c(B2)=c(AB3)
参考答案:C
本题解析:可逆反应已经达到化学平衡状态的标志:(1)正、逆反应速率相等;(2)体系中各组分的浓度保持不变;
①?平衡,体积固定的密闭容器中,当各组分的物质的量不随时间而变化,即浓度不变;
②平衡,该反应为非等体积反应,混合气体的总物质的量不随时间而变化,即各组分的浓度不变的状态;
③平衡,容器内的压强不随时间而变化,即体系内气体的总物质的量不变,由于反应为非等体积反应,即各组分的浓度不变;
④平衡,相同温度下体积固定的密闭容器中,容器内气体的平均相对分子质量不随时间而变化,即气体的总物质的量不变的状态,在非等体积反应中,即达平衡;
⑤不一定平衡,体积固定的密闭容器,且反应物和生成物均为气体的状态下,无论平衡与否,容器内气体的密度均不会发生改变;
⑥不一定平衡,速率之比遵循化学计量数之比,不一定说明平衡了,可能平衡也可能未平衡;
⑦平衡,
⑧不一定平衡,浓度之比=化学计量数之比也不一定说明。
⑨不一定平衡,浓度相等也不一定。
本题难度:一般
3、选择题 在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
A.在该条件下,反应前后的压强之比为6:5.3
B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min)
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
参考答案:C
本题解析:A、反应在恒温恒压条件下进行,应前后的压强之比为1;1,故A错误;B、若容器体积不变,则v(SO3)=0.35mol/(L?min),但反应是在恒温恒压条件进行,混合气体平衡后的体积分数改变,越强高有利于平衡向正反应进行,因此v(SO3)>0.35mol/(L?min),故B错误;C、若把“恒温恒压下”改为“恒压绝热条件下”反应,反应是放热反应,绝热温度升高,平衡逆向进行,平衡后n(SO3)<1.4mol,故C正确;D、若把“恒温恒压下”改为“恒温恒容下”反应,反应过程中压强减小,平衡逆向进行,达平衡时放出热量小于Q kJ,故D错误;故选:C。
本题难度:一般
4、选择题 把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
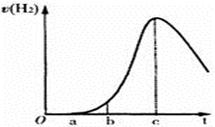
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
参考答案:C
本题解析:金属铝与稀硫酸的反应不是可逆反应,不存在平衡状态,选项C不正确,其余选项都是正确的,答案选C。
本题难度:简单
5、选择题 在一定条件下化学反应:2SO2(g)+O2(g) 2SO3(g);△H=-197 kJ/mol?现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol?现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
容器
| SO2(mol)
| O2 (mol)
| N2 (mol)
| Q(kJ)
|
甲
| 2
| 1
| 0
| Q1
|
乙
| 1
| 0.5
| 0
| Q2
|
丙
| 1
| 0.5
| 1
| Q3
|
根据以上数据,下列叙述不正确的是?
A.在上述条件下反应生成1 molSO3气体放热98.5 kJ
B.2Q2=2Q3<Q1<197 kJ
C.Q1=2Q2=2Q3="197"
D.在上述条件下每摩该反应进行到底时放出的热量为197 kJ
参考答案:C
本题解析:乙、丙两个容器容积相同,所充气体物质的量相同,丙中所充氮气对平衡无影响。所以乙、丙建立等效平衡,转化率相同,Q1>Q2=Q3,故C错误。
本题难度:一般