微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则A+是 ,B―是 ,C是______,D是______。
参考答案:A+是 NH4+,B―是 OH-? ,C是_NH3___ ,D是__H2O_____。
本题解析:电子总数为10个的粒子一般在氖原子附近寻找,然后跟氢元素搭配,把含10电子的元素都一一写出来,然后带入题目,结合溶液中的A+和B―在加热时相互反应可转化为C和D,此反应应为NH4+?+? OH-?=? NH3?+? H2O,不难得出上述答案。
本题难度:一般
2、选择题 已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
参考答案:B
本题解析:因为钡的金属活动性处于钾和钠之间,故能与水剧烈反应,B正确;A、钡放入氯化钠溶液中,与溶液中的水反应,故A错误;钡放入硫酸铜溶液中,与水反应,故C错误;钡比锌活泼,钡离子的氧化性比锌离子弱,故不能氧化金属锌生成锌离子,故D错误;故选B。
本题难度:简单
3、填空题 (14分)X、Y、Z、W、R是五种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y?元素原子的最外层电子数是其次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。请填写下列空白:
(1)画出W的原子结构示意图;?。
(2)Z和W最高价氧化物的水化物的碱性较强的是:?(写化学式),它们之间在溶液中反应的离子方程式是;?;
(3)Z2Y2 中阴离子的化学式是?。
(4)在同周期元素中,R 元素及与其相邻元素的原子半径从大到小的顺序是:?。与R元素同周期且非金属性最强的元素是:?。
(5)W的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料,其反应的化学方程式是:?。
参考答案:(每空2分,共14分)(1)略。
(2)NaOH;?Al(OH)3 +OH-=AlO2-+2H2O。
(3)O22-。?(4) P﹥S﹥Cl;?氯或Cl。
(5)4Al+3C+3TiO2 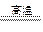 ?2Al2O3 +3TiC
?2Al2O3 +3TiC
本题解析:略
本题难度:简单
4、填空题 (5分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
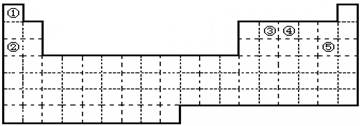
(1)上述五种元素中,金属性最强的元素在周期表中的位置是?,
该元素的单质在空气中加热的化学方程式为?。
(2)元素①和④形成化合物的电子式是?,其水溶液呈?(填“碱性”、“酸性”或“中性”)。
(3)试用电子式表示元素⑤单质分子的形成过程?。
参考答案:(1)第三周期第IA?2Na+O2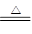 Na2O2
Na2O2
(2)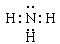 碱性?(3)
碱性?(3)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断,①~⑤分别是H、Na、C、N、Cl。
(1)金属性最强的是Na,位于第三周期第IA。钠在空气中燃烧生成过氧化钠,方程式为2Na+O2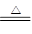 Na2O2。
Na2O2。
(2)H和N都是非金属,通过共价键形成氨气,氨气溶于水生成一水合氨,显碱性。
(3)氯气是通过非极性键形成的单质分子,其形成过程为。
本题难度:一般
5、填空题 (14分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a
| ?
| b
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| c
| d
| ?
| ?
|
e
| f
| g
| h
| ?
| ?
| i
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| j
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)j是钴元素,试画出该元素的原子结构示意图?。
(2)c、d原子半径大小c?d,第一电离能大小关系是c?d,电负性大小关系是c?d。(以上填“>”” “<”)
(3)已知NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____?__ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____?__ (填序号) 。

(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力?②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
?
| 锂
| X
| Y
|
失去第一个电子
| 519
| 502
| 580
|
失去第二个电子
| 7296
| 4570
| 1820
|
失去第三个电子
| 11799
| 6920
| 2750
|
失去第四个电子
| ?
| 9550
| 11600
|
表中X、Y可能分别为以上元素中的?、?(填写元素符号)元素。
参考答案:(14分)(1) (2分)?(2)>(2分)? >(2分)? <(2分)
(2分)?(2)>(2分)? >(2分)? <(2分)
(3)b(2分)?(4)Na(2分)? Al(2分)
本题解析:考查元素周期表的结构及元素周期律的应用。
(1)根据钴元素在周期表中的位置可知,钴元素的原子序数是27,所以该元素的原子结构示意图为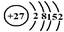 。
。
(2)c、d原子分别是N和O。由于同周期自左向右原子半径逐渐减小,所以碳原子半径大于氮原子半径。非金属性越强,第一电离能越大,氧元素的非金属性强于氮元素的,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能是氮元素大于氧元素;非金属性越强,电负性越大,所以氧元素的电负性强于氮元素的。
(3)应用氮元素的非金属性强,能和水中的氢元素形成氢键,所以形成的NH3·H2O的合理结构是b,即答案选b。
(4)X原子失去第二个电子需要的能量远高于失去第一个电子需要的能量,又因为X的第一电离能小于LI的,因此X是第IA元素,所以X是Na 。Y原子失去第四个电子需要的能量远高于失去第三个电子需要的能量,因此Y是第ⅢA元素。又因为Y的第一电离能大于钠的第一电离能,所以Y是Al。
本题难度:一般