|
高中化学必备知识点《铁的氧化物》试题巩固(2017年最新版)(八)
2017-03-03 00:45:45
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 材料是人类赖以生存的重要物质基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
(1)合金是被广泛应用的金属材料。
① 下列有关合金性质的说法正确的是________________(填字母)。
A.合金的熔点一般比它的成分金属高B.合金的硬度一般比它的成分金属低
C.组成合金的元素种类相同,合金的性能就一定相同
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
② 钢属于_______________(填“铁合金”或“铝合金”)。
③ 铁锈蚀主要发生的是电化学腐蚀,其负极反应式为________。
(2)无机非金属材料包括玻 璃、水泥和___________________。 璃、水泥和___________________。
(3)合成塑料、合成橡胶和____________是常说的三大合成材料。下列属于塑料制品的是_______(填字母)。A.汽车轮胎B.涤纶? C.聚乙烯制品? D.玻璃钢
参考答案:
本题解析:略
本题难度:一般
2、选择题 检查钢质设备完好性的方法之一是在被怀疑有裂纹处涂上10%的盐酸,过一段时间,如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是( )?
A.裂纹处尘埃多,起催化作用?
B.裂纹里面含水分?
C.裂纹处铁的表面积大,反应快?
D.原裂纹处的Fe2O3与盐酸反应,生成可溶的FeCl3?
参考答案:D
本题解析:有粗线裂纹出现,表明该处的反应比其他地方快,即该处应有不同于Fe的性质的物质存在,该物质只能是Fe2O3或Fe(OH)3等碱性物质,故应选D。?
本题难度:简单
3、实验题 [2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
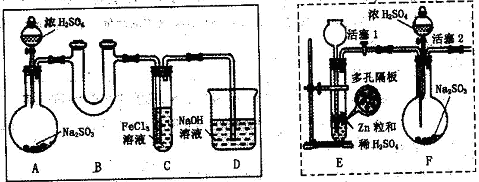 ? ?
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为?。
②装置B的作用是?。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需?。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会??(填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是?。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是?。(选填序号)
A.SO2溶解量太小
B.SO2不与Fe3+发生反应
C.H2SO3与BaCl2不反应
D.装置中的空气与SO2进入水中也可生成H2SO4
| ②乙同学的实验结论不严谨的原因是?。
参考答案:(11分)(1)①Na2SO3+H2SO4=Na2SO4+SO2↑+H2O?②防倒吸
(2)①500mL容量瓶(无型号不得分)?偏低?②排尽装置中的空气
(3)①D?②SO2也能使高锰酸钾溶液褪色
本题解析:(1)①硫酸的酸性强于亚硫酸,硫酸与亚硫酸反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。②装置B的作用显然是防止倒吸。
(2)①要配制450mL3mol/L的稀硫酸,由于实验室中无450mL的容量瓶,故应选用500mL的容量瓶;配制过程中未洗涤烧杯与玻璃棒,会造成溶质损失,致使所配溶液浓度偏低。②乙同学用H2排尽装置中的空气,以防止发生反应SO2+H2O+O2=H2SO4。
(3)①乙同学设计用H2排尽装置中的空气来改进甲同学的实验,正是对甲同学实验不严谨的改进,因为SO2溶于水生成H2SO3,装置中的O2会把H2SO3氧化成H2SO4。
②丙同学对乙同学实验的改进也正是乙同学实验不够严谨之处,因为Fe2+能使KMnO4溶液褪色,SO2也能使KMnO4溶液褪色。
本题难度:一般
4、简答题 试样A是由氧化铁和氧化铜组成.取质量相等的两份试样按下图进行实验,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体.

(1)写出反应①中氧化铁与铝粉反应的反应方程式:______.
(2)溶液G中的溶质是______.
(3)写出反应②有关的两个离子方程式:______;______.
参考答案:依据流程图分析可知,试样A为氧化铜和氧化铁,加入过量铝粉高温反应,生成铁和氧化铝,固体B为Al、Al2O3、CuO、Fe;固体B加入过量氢氧化钠溶液为Al、Al2O3和氢氧化钠溶液反应生成偏铝酸钠溶液,过滤得到溶液D为偏铝酸钠溶液,固体E为CuO、Fe,溶液C为FeCl3,CuCl2溶液,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体证明含有铁,说明铁过量,溶液G中溶质为FeCl2,
(1)反应①中氧化铁与铝粉反应的反应方程式为:Fe2O3+2Al高温.Al2O3+2Fe,
故答案为:Fe2O3+2Al高温.Al2O3+2Fe;
(2)结合分析过程可知G为氯化亚铁,故答案为:FeCl2;
(3)反应②有关的两个离子方程式是铝和氢氧化钠溶液反应,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;氧化铝和氢氧化钠溶液反应,反应的离子方程式为:
Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+H2O.
本题解析:
本题难度:一般
5、实验题 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。
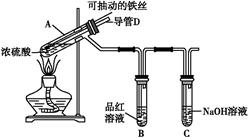
(1)实验过程中,观察到B中的实验现象是? 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 ?。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是? ;
反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是? 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2: ?;?
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作步骤、实验现象及结论。限选试剂:酸性KMnO4溶液、NaOH溶液、淀粉KI溶液、KSCN溶液。
?
参考答案:(1)品红溶液褪色 H2
(2)便于控制铁与浓硫酸的反应和停止 从D管口向A中鼓入大量的空气
(3)①溶液中只存在Fe3+
②
实验操作步骤
实验现象
结论
方法一:取少量A中溶液分别加入甲、乙两支试管中;甲中滴加少量酸性高锰酸钾溶液;乙中滴加少量KSCN溶液
甲中高锰酸钾溶液褪色;乙中KSCN溶液不变红
溶液中存在Fe2+,不存在Fe3+
方法二:取少量A中溶液加入试管中,滴入少量KSCN溶液,一段时间后再加入少量氯水
加入KSCN溶液不显红色,继续加入少量氯水,溶液显红色
溶液中不存在Fe3+,存在Fe2+
本题解析:(1)A中开始可能发生的反应有:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3 Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3 3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。 3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
(2)将抽动的铁丝脱离液面,反应停止,将抽动的铁丝插入液面,反应开始;鼓入空气将试管内的气体排出。
(3)检验Fe2+时必须防止Fe3+的干扰,Fe3+与酸性高锰酸钾溶液不反应,而Fe2+具有较强的还原性,因此Fe2+能使酸性高锰酸钾溶液褪色,选择酸性高锰酸钾溶液。但必须还要证明溶液中不含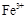 选用KSCN溶液。 选用KSCN溶液。
本题难度:一般
|