微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 由碳棒、铁片和200mL稀H2SO4(足量)组成的原电池中,当在碳棒上共放出3.36L(标准状况)气体时,求消耗铁多少克?有多少个电子通过了导线?
参考答案:设需要消耗铁x.
该原电池的电池反应式为:
? Fe+H2SO4=FeSO4+H2↑
? 56g? 22.4L
? x?3.36L
所以x=56g?×?3.36L22.4L=8.4g
即消耗铁8.4g.
设转移电子y.
?Fe+H2SO4=FeSO4+H2↑ 转移电子
?22.4L? 1.204×1023个
?3.36L? y
所以y═3.36L×1.204×1023个22.4L?=1.806×1023个
故答案为:8.4g;1.806×1023个.
本题解析:
本题难度:一般
2、填空题 (9分)(1)由盖斯定律结合下述反应方程式,回答问题:
(1)NH3(g)+HCl(g)=NH4Cl(s) △H= —176KJ/moL
(2)NH3(g)+H2O(l)=NH3
参考答案:
本题解析:
本题难度:困难
3、选择题 下图为一原电池装置,下列叙述中正确的是

[? ]
A.该装置中电子由Zn极流向Cu极,溶液中的SO42-通过盐桥移向Zn极
B.将上述装置中的Zn棒和Cu棒同时浸入CuSO4溶液,电流 计的指针偏转幅度变小,且很快减弱
C.将烧杯内溶液对换,电流计指针也能发生偏转
D.将盐桥改为铜导线连接两种溶液,电流由Cu极移向Zn极
参考答案:B
本题解析:
本题难度:一般
4、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol
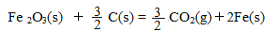 △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
参考答案:(1)NO3- + Al +H2O→ Al(OH)3 + N2 + OH-(2分) 5∶3
(2)O2+4e-+2H2O=4OH- 1.5
(3)2 Al(s) + Fe2O3 (s)= 2 Fe(s) +Al2O3 (s) △H = - 600 kJ/mol a c
本题解析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al为还原剂,则Al(OH)3为氧化产物,再根据电荷守恒和原子守恒可得:NO3- + Al +H2O→ Al(OH)3 + N2 + OH-;Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知,x×(3-0)=y×(5-0),解得x:y=5:3,所以被氧化与被还原的元素的物质的量之比为5∶3。
(2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,正极反应为2H2O+O2+4e-=4OH-;Al元素由0价升高为+3价,则 Al~3e?,所以消耗13.5 g Al时转移电子:13.5g÷27g/mol×3=1.5mol。
(3)首先写出化学方程式并注明各物质的状态,然后根据盖斯定律求出?H,?H="1/2" ?H1+?H2
本题难度:困难
5、选择题 15.把锌片和铁片放在盛有稀食盐水和K3[Fe(CN)6]试液混合溶液的培养皿中(如图所示平面图),经过一段时间后,下列说法中正确的是
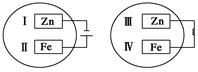
A.Ⅰ附近溶液pH降低
B.Ⅱ附近很快出现蓝色沉淀
C.Ⅲ附近产生黄绿色气体
D.Ⅳ附近很快生成铁锈