微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为______.
(2)X、Y、Z三种元素第一电离能从大到小顺序为______.
(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是______
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是______
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式______
(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是______

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.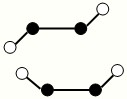
参考答案:X、Y、Z、Q为短周期非金属元素,R是长周期元素.
X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,且为非金属,则X为C元素;Y的基态原子有7种不同运动状态的电子,则Y为N元素;
Z元素在地壳中含量最多,则Z为O元素;Q是电负性最大的元素,则Q为F元素;R+离子只有三个电子层且完全充满电子,则R为Cu元素.由分析可知:X为C元素;Y为N元素;Z为O元素;Q为F元素;R为Cu元素.
(1)R为Cu元素,基态原子的电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,
第一电离能大于O,所以第一电离能从大到小的顺序为:N>O>C,故答案为:N>O>C;
(3)Y2Q2为N2F2,有如图2种结构,N原子之间形成N═N双键,①N原子之间形成N═N双键,含有1个σ键和1个π键,故选C;
②杂化轨道数=σ键数+孤对电子对数,该分子中N原子的杂化轨道数=2+1=3,所以N原子杂化方式是sp2杂化,故答案为:sp2杂化;
(4)[R(H2O)4]2+为[Cu(H2O)4]2+,离子结构式为
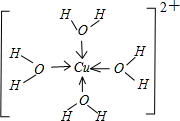
,故答案为:

;
(5)A、X与Y元素可以形成一种超硬新材料,由晶体部分结构可知,该晶体为原子晶体,故A错误;
B、C-N键键长比C-C键长短,C-N键键能大,所以晶体的硬度比金刚石还大,故B正确;
C、结构中每个X原子周围有4个Y原子,每个Y原子周围有3个X原子,所以该晶体化学式为X3Y4,即为C3N4,故C正确;
D、该晶体为原子晶体,晶体熔化时共价键被破坏,没有克服范德华力和氢键,故D正确.
故答案为:BCD.
本题解析:
本题难度:一般
2、简答题 A+、B+、C-、D、E五种微粒(分子或离子),每个微粒均含有10个电子.已知:①A++C-
D+E↑?②B++C-→2D
请回答以下问题:
(1)C-离子含有的化学键为______.
(2)具有相同空间构型的微粒是______和______.
(3)分别写出A+和D反应,B+和E反应的离子方程式.
A++D:______B++E:______.
参考答案:(1)C-为OH-,非金属元素之间形成共价键.
故答案为:共价键.
(2)A+为NH4+是正四面体型,B+为H3O+是三角锥型,C-为OH-是直线型,D为H2O是角型,E为NH3是三角锥型
故答案为:NH3;H3O+.
(3)A+和D反应的离子方程式为NH4++H2O≒NH3?H2O+H+,B+和E反应的离子方程式NH3+H3O+=NH4++H2O.
故答案为:NH4++H2O≒NH3?H2O+H+;NH3+H3O+=NH4++H2O.
本题解析:
本题难度:一般
3、选择题 下列微粒中与OH-离子具有相同的质子数和相同的电子数,该微粒可能为( )
A.F-
B.Mg2+
C.NH4+
D.CH4
参考答案:OH-的质子数为8+1=9,OH-的电子数为9+1=10,
A、F-的质子数等于9,电子数为9+1=10,故A正确;
B、Mg2+的质子数为12,电子数为12-2=10,故B错误;
C、NH4+的质子数为7+4=11,电子数为11-1=10,故C错误;
D、CH4的质子数为6+4=10,电子数为10,故D错误;
故选:A.
本题解析:
本题难度:简单
4、简答题 尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].
(1)基态Fe3+的核外电子排布式为______.C、N、O三种元素的第一电离能由大到小的顺序是______.
(2)尿素分子中C、N原子的杂化方式分别是______.
(3)[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是______.与NO3-互为等电子体的一种化合物是______(写化学式).
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示.
①1个CO2分子周围等距离且距离最近的CO2分子有______个.
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是______.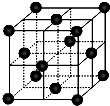
参考答案:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,
同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:1s22s22p63s23p63d5;N>O>C;
(2)由尿素分子的结构式

可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2、sp3;
(3)Fe(Ⅲ)有空轨道,尿素分子中N原子含有孤对电子,H2NCONH2与Fe(Ⅲ)之间形成配位键,
N原子最外层电子数为5,将N原子及1个单位负电荷,可以替换为S原子,故SO3与NO3-互为等电子体,
故答案为:配位键;SO3等;
(4)①以顶点的二氧化碳分子研究,与之最近的二氧化碳分子位于面心上,将晶胞补全可知,有3层每各有4个二氧化碳分子与之最近,故之最近的二氧化碳分子有4×3=12,
故答案为:12;
②若顶点为Au、面心为Cu,晶胞中含有Au原子数目为8×18=1,晶胞中含有Cu原子数目为6×12=3,则铜金合金晶体中Au与Cu原子数之比为1:3,
故答案为:1:3.
本题解析:
本题难度:一般
5、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O
B.NH3
C.Cl2
D.BCl3
参考答案:C
本题解析:
本题难度:一般