微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Al2(SO4)3、MgSO4、K2SO4的混合溶液中,含有的Al3+、Mg2+、SO42-的个数比是2:3:8,则溶液中Al2(SO4)3、MgSO4、K2SO4的物质的量之比是( )
A.1:2:4
B.2:3:2
C.1:2:3
D.1:3:2
参考答案:溶液呈电中性,则阴阳离子所带电荷相等,设K+的个数与Al3+、Mg2+、SO42-的个数比是x:2:3:8,则x+2×3+3×2=2×8,所以x=4,同一溶液中离子的个数之比等于其浓度之比,再根据其化学式知Al2(SO4)3、MgSO4、K2SO4的物质的量浓度之比为22:3:42=1:3:2,同一溶液中各物质的物质的量之比等于其物质的量浓度之比,
故选D.
本题解析:
本题难度:简单
2、填空题 _______mol的CO2中含有3g碳,_______mol的CO2中含有0.25 mol氧原子,_______mol CO2中含有
3.01×1023个CO2分子,它的质量为_______g。
参考答案:0. 25;0. 125;0. 5;22
本题解析:
本题难度:一般
3、选择题 同温、同压下,相同体积的下列气体质量最大的是?
A.氧气
B.甲烷
C.二氧化碳
D.氯气
参考答案:D
本题解析:略
本题难度:一般
4、选择题 向100 mL BaCl2、AlCl3、FeCl3的混合液A中逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量和加入溶液B的体积关系如图所示:则Na2SO4与FeCl3的物质的量浓度之比为
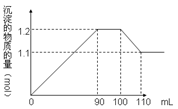
A.1︰1
B.10︰1
C.2︰1
D.5︰1
参考答案:B
本题解析:
正确答案:B
观察图:可得以下结论,
(1)加入B溶液110 mL时,Al(OH)3沉淀溶解完全,剩下沉淀BaSO4、Fe(OH)3。
(2)90—100 mL时这10 mL B溶液的滴加、Al(OH)3沉淀的溶解及BaSO4沉淀的生成同时发生: Ba2++SO42―=BaSO4↓,Al(OH)3+OH-=AlO2―+2H2O,并且物质的量相等,得出Na2SO4与NaOH的物质的量相等,即浓度相同。
(3)根据100—110 mL时B溶解Al(OH)3?0.01 mol,可得出90—110 mL时B溶解Al(OH)3?0.02 mol;又根据90—100 mL时这10 mL B溶液生成BaSO4?0.01 mol,所以总共有BaSO4为0.1 mol,最后Fe(OH)3为0.11 mol-0.1 mol="0.01" mol。
得出Na2SO4与FeCl3的物质的量浓度之比为(0.1mol/0.1L):(0.01mol/0.1L)=10:1,B选项正确。
附:各种物质的浓度如下表
溶质
Na2SO4
NaOH
BaCl2
AlCl3
FeCl3
浓度/mol·L-1
1
1
1
0.2
0.1
本题难度:一般
5、简答题 欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液500mL.试回答下列问题:
(1)你所需要量取的浓硫酸的体积为______mL;
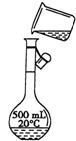
(2)除右图中仪器外,本实验还需要用到的玻璃仪器有:胶头滴管、______、______;右图是某同学转移溶液的示意图,请改正图中的错误:______;
(3)配制过程中,造成浓度偏高的操作可能有______(填序号).
A.容量瓶用蒸馏水洗后未干燥
B.将烧杯中溶解后的溶液立即转移入容量瓶,然后再加蒸馏水至刻度线
C.未用水洗涤溶解过浓硫酸的烧杯
D.用量筒量取浓硫酸时,俯视读数
E.定容时,俯视液面加水至刻度线
F.向容量瓶中转移浓溶液时不慎有液滴掉在容量瓶外面.
参考答案:(1)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为:1000×1.84×98%98mol/L=18.4mol/L,配制0.2mol/L的硫酸溶液500mL,需要浓硫酸的体积为:0.2mol/L×0.5L18.4mol/L≈0.0054L=5.4mL,
故答案为:5.4;
(2)用量筒量取浓硫酸,在烧杯中溶解,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:10mL量筒、胶头滴管、烧杯、玻璃棒、500mL容量瓶;图中没有使用玻璃棒引流,容易导致溶液流到容量瓶外面,
故答案为:10mL量筒;玻璃棒;应用玻璃棒引流;
(3)A.容量瓶用蒸馏水洗后未干燥,由于定容时还需要加入蒸馏水,容量瓶中有蒸馏水不影响配制结果,故A错误;
B.将烧杯中溶解后的溶液立即转移入容量瓶,然后再加蒸馏水至刻度线,热的溶液体积偏大,冷却后溶液体积变小,根据c=nV可知,配制的溶液浓度偏高,故B正确;
C.未用水洗涤溶解过浓硫酸的烧杯,导致配制的溶液中溶质的物质的量偏小,根据c=nV可知,配制的溶液浓度偏低,故C错误;
D.用量筒量取浓硫酸时,俯视读数,导致量取的浓硫酸体积偏小,根据c=nV可知,配制的溶液浓度偏低,故D错误;
E.定容时,俯视液面加水至刻度线,导致加入的蒸馏水体积偏小,根据c=nV可知,配制的溶液浓度偏高,故E正确;
F.向容量瓶中转移浓溶液时不慎有液滴掉在容量瓶外面,导致配制的溶液中溶质的物质的量偏小,根据c=nV可知,配制的溶液浓度偏低,故F错误;
故选BE.
本题解析:
本题难度:一般