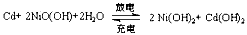|
高中化学知识点讲解《常见的化学电源》试题强化练习(2017年最新版)(四)
2017-03-03 00:56:14
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
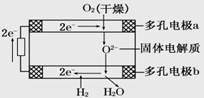
A.有O2放电的a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为2H2-4e-+2O2-==2H2O
D.a极对应的电极反应为O2+2H2O+4e-==4OH-
|
参考答案:C
本题解析:A、电子流向a电极,因此a电极正极,A错误;B、原电池中阴离子向负极移动,则O2-移向电池的负极,B错误;C、b电极是正极,氢气得到电子,电极反应式为2H2-4e-+2O2-==2H2O,C正确;D、a极是负极,氧离子失去电子,电极反应为2O2——4e-==O2↑,D错误,答案选C。
考点:考查原电池原理的应用
本题难度:一般
2、填空题 (14分)
(1)最早使用的化学电池是锌锰电池,即大家熟悉的干电池。这种电池在使用过程中,锌外壳会逐渐变薄,最后内部糊状的电解质会泄漏出来,使电器腐蚀。后来人们采用了什么方法将其改造成了防漏电池。请列举一种方法即可_____________。
这种电池还有一个缺点:即使不用,放置过久,也会失效,请说明失效的原因_________。
(2)为提高电池寿命和提高其性能,人们将电池内的电解质NH4Cl换成湿的KOH,并在构造上做了改进,制成了碱性锌锰电池。其总反应为:
Zn + 2MnO2 + 2H2O ="===" 2MnOOH + Zn(OH)2
写出该电池正极反应式___________。电池工作时,电子流向?(填“正”或“负”)极。
(3)二氧化锰是制造锌锰干电池的基本材料。MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是?。若电解电路中通过2mol电子,MnO2的理论产量为?。
(4)生产MnO2另一种方法:以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰。流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
| Zn(OH)2
| CuS
| ZnS
| MnS
| FeS
| pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
| 8.0
| ≥–0.42
| ≥2.5
| ≥7
| ≥7
|
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式
为?。
②加入MnS的目的是除去?杂质。
参考答案:
(1)在外壳套上防腐金属筒或塑料筒? 1分
作为电解质的NH4Cl的水溶液会水解使溶液显酸性2分
(2)MnO2+H2O+e-=MnOOH+OH-? 2分?正极? 1分
(3)2H++2e-=H2↑?2分? 87g?2分
(4)①MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O? 2分
②Cu2+? Zn2+?各1分
本题解析:略
本题难度:一般
3、填空题 (6分)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
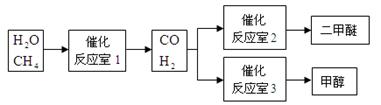
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH = -90.8kJ·mol-1 CH3OH(g) ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH = -41.3kJ·mol-1 CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH = 。 CH3OCH3(g)+CO2(g);ΔH = 。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
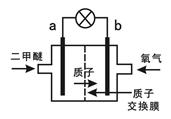
电极a的电极反应式为 。
参考答案:(1)CH4+H2O CO+3H2 (2分)(2)-246.4kJ·mol-1(2分,无单位不得分) CO+3H2 (2分)(2)-246.4kJ·mol-1(2分,无单位不得分)
(3)CH3OCH3-12e-+3H2O 2CO2+12H+(2分) 2CO2+12H+(2分)
本题解析:(1)从流程图看出CH4和H2O在催化剂的作用下反应生成了 CO和H2,化学方程式为:CH4+H2O CO+3H2 (2)①×2+②+③可得总反应,则ΔH =-90.8×2-23.5-41.3=-246.4kJ·mol-1[来(3)在燃料电池中,燃料反应的一极是负极,氧气反应的一极是正极,所以a是负极,失去电子,电极反应为:CH3OCH3-12e-+3H2O CO+3H2 (2)①×2+②+③可得总反应,则ΔH =-90.8×2-23.5-41.3=-246.4kJ·mol-1[来(3)在燃料电池中,燃料反应的一极是负极,氧气反应的一极是正极,所以a是负极,失去电子,电极反应为:CH3OCH3-12e-+3H2O 2CO2+12H+[ 2CO2+12H+[
考点:根据条件书写化学方程式、热化学方程式的计算、燃料电池电极反应的书写。
本题难度:困难
4、选择题 目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的 陶瓷作固体电解质,反应为 陶瓷作固体电解质,反应为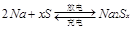 ,以下说法正确的是 ,以下说法正确的是
A.放电时,硫作负极,电极反应式为: 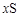 +2e-=Sx2- +2e-=Sx2-
B.放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子
C.该反应一定是一个自发进行的吸热反应。
D.放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠
|