|
|
|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2017年模拟版)(四)
2017-03-03 00:57:33
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化不属于盐类水解反应的是
[? ]
①NH3+H2O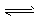 NH4++OH- NH4++OH-
②HCO3-+H2O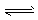 H2CO3+OH- H2CO3+OH-
③HCO3-+H2O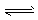 H3O++CO32- H3O++CO32-
④Al3++3HCO3-== Al(OH)3↓+3CO2↑
⑤AlO2-+HCO3-+H2O==Al(OH)3↓+CO32-
⑥NH4++ 2H2O NH3·H2O+H3O+ NH3·H2O+H3O+
A.①③⑤
B.②③⑤
C.①④⑤
D.①③
参考答案:B
本题解析:
本题难度:一般
2、简答题 (20分)硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有 。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为 。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式 。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。

①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。

②经搅拌Ⅱ,pH下降的原因是 。
③凝胶中含有的硝酸盐是 。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化: 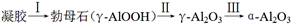 。 。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:

(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是 (填序号),转化Ⅲ开始的温度是 。
参考答案:(20分)
(1)B(2分)
(2)2Al+6H+ 2Al3++3H2↑(3分) 2Al3++3H2↑(3分)
(3)[Al(OH)]2++H2O [Al(OH)2]++H+(3分) [Al(OH)2]++H+(3分)
(4)①1 10 6 4 NH4+ 4 (3分)
②经搅拌后,促进了Al3+的水解(2分)
③Al(NO3)3 NH4NO3 (3分)
④ i (2分) 600℃ (2分)
本题解析:(1)硝酸铝中氮元素的化合价为+5,处于最高价,所以硝酸铝具有氧化性,在实验室中,硝酸铝必须与可燃物分开存放,故B项正确。
(2)Al作电极电解HNO3溶液制取Al(NO3)3,阳极上Al失电子生成Al3+,阴极上H+得电子生成H2,所以电解反应的离子方程式为:2Al+6H+ 2Al3++3H2↑。 2Al3++3H2↑。
(3)[Al(OH)]2+结合H2O中的羟基可转化为[Al(OH)2]+,所以离子方程式为:[Al(OH)]2++H2O [Al(OH)2]++H+。 [Al(OH)2]++H+。
(4)①根据元素守恒和电荷守恒,可知所缺离子为阳离子且含有N元素,为NH4+,根据观察法可配平该离子方程式。
②溶液中含有Al3+,经搅拌Ⅱ,Al3+的水解程度增大,所以pH下降。
③加入(CH2)6N4后生成NH4+,所以溶液中含有NH4NO3,根据pH=3.95可得c(OH?)=10-14÷10-3.95=10-10.05,则c(Al3+)=Ksp[Al(OH)3]÷c(OH?)3=1.3×10-33÷(10-10.05)3=1.3×10-2.85mol?L?1>1×10-5 mol·L-1,所以溶液还含有Al(NO3)3。
④转化II由γ-AlOOH转化为γ-Al2O3,失重率=18÷120×100%=12%,根据图像可知对应的失重阶段是i;转化III有γ-Al2O3转化为α-Al2O3,根据图像可知对应的失重阶段是iii,开始温度是600℃。
考点:本题考查物质的性质及应用、电解原理、方程式的配平及书写、化学流程及图像的分析。
本题难度:困难
3、选择题 在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是( )
A.c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C.c(Na+)=c(HCO3-)>c(OH-)>c(H+)
D.c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
|
参考答案:B
本题解析:由于碳酸氢钠的水解程度大于电离程度,所以碳酸氢钠溶液显碱性,A和C都不正确;B正确,符合电荷守恒定律;D不正确,不符合物料守恒,应该是c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),答案选B。
考点:考查溶液中离子浓度大小比较
点评:在判断溶液中离子浓度时,需要注意几个关系式,即电荷守恒、物料守恒和质子守恒。
本题难度:困难
4、填空题 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质有一定的相似性;Mg和Na的化学性质也有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
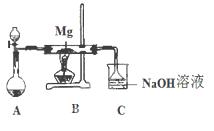
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4
③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,实验后装置C中所得溶液离子浓度关系一定正确的是(选填字母)
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(SO32-)> c(H+)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-)
|
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
乙同学的推测是:2Mg+3SO2

2MgSO3+S;
丙同学的推测是:3Mg+SO2

2MgO+MgS,
要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。请填写下表中的空格:
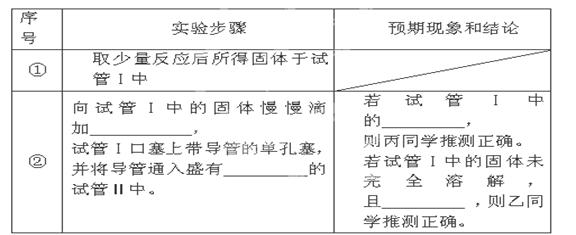
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是_________________ _
(4)上述实验需要50mL,2mol/L的HCl,配制时应选用
(10 mL ,25 mL ,,50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积。
参考答案:(1)②③(2分)
(2)在A和B之间增加用浓硫酸干燥的装置(2分); D(2分)
(3)2Mg+SO2  2MgO+S;(2分)
2MgO+S;(2分)
②
2mol/L 盐酸至过量(1分);
品红(1分)
固体完全溶解;(1分)
品红溶液褪色(1分);
向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无色气体产生)(2分)
(4)10ml
本题解析:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水);
(2)SiO2、CO2都是酸性氧化物,所以镁与玻璃中的二氧化硅能发生反应,镁不能与玻璃管直接接触;又因为镁与钠的性质相似,能与水反应,因此A、B间应加干燥装置;实验后装置C中为Na2SO3溶液,A、根据物料守恒可得:(Na+)= 2c(SO32-)+2 c(HSO3-)+2c(H2SO3),错误;B、Na2SO3分两步水解,以第一步为主,可得:(Na+)> c(OH-)> c(HSO3-)> c(SO32-)> c(H+),错误;C、根据质子守恒可得:(OH-)= c(HSO3-)+ 2(H2SO3)+ c(H+),错误;D、根据电荷守恒可得:(Na+)+ c(H+)=" 2" c(SO32-)+ c(HSO3-)+ c(OH-),正确。
(3)根据Mg与CO2的反应可类比得:2Mg+SO2  2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
(4)设需要浓盐酸的体积为V,可得:0.05L×2mol/L×36.5g/mol=V×1.19g/mL×36.5%,则V=8.4mL,所以选择10mL量筒量取。
考点:本题考查制取气体试剂的选择、反应装置的选用、离子浓度比较、反应方案的分析、浓度的计算。
本题难度:困难
5、选择题 物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中pH最大的是
A.Na2CO3溶液
B.NH4HCO3溶液
C.NaHCO3溶液
D.NaHSO4溶液
参考答案:C
本题解析:试题分析:既能跟NaOH溶液反应,又能跟盐酸反应的溶液只有NH4HCO3溶液和NaHCO3溶液,NH4+水解呈酸性,所以溶液的pH相对来说比较小,Na+不水解,所以溶液的pH相对来说比较大,因此选C。考点:盐类的水解点评:这类习题是高考重点习题,要掌握盐类水解的规律才能正确的判断溶液的酸碱性强弱。
本题难度:一般
 2MgSO3+S;
2MgSO3+S; 2MgO+MgS,
2MgO+MgS,
 2MgO+S;(2分)
2MgO+S;(2分) 2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。
2MgO+S;先加入2mol/L 盐酸至过量,可检验产物中是否含有MgS,气体通入品红可检验是否生成了MgSO3,若试管Ⅰ固体完全溶解,说明没有S,则丙同学推测正确;若试管Ⅰ固体未完全溶解且品红溶液褪色,说明产物含有MgSO3,则乙同学推测正确;因为甲同学推测生成MgO和S,所以能证明甲同学推测正确的操作和预期现象是:向反应后所得固体加过量2mol?L?1盐酸,固体未完全溶解且品红溶液不褪色。