| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2017年模拟版)(六)
参考答案:D 本题解析:A、根据图像可知A点AG=0,则c(H+)= c(OH-),即溶液显中性。由于醋酸钠水解显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,A错误;B、开始是AG=6,则根据AG=lg 本题难度:一般 2、选择题 下列有关说法正确的是 |
参 考答案:BD
本题解析:A、虽然合金在潮湿的空气中易形成原电池,但并不是所有合金耐腐蚀性都较差,如不锈钢具有较强的抗腐蚀性,错误;B、MgO(s)+C(s)=Mg(s)+CO(g)为气体物质的量增大的熵增加反应,常温下,该反应不能自发进行,则其△H>0,正确;C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,不一定先产生淡黄色沉淀溴化银,还与氯离子和溴离子浓度有关,错误; D、铝离子水解吸热,加热0.1 mol·L-1Al2(SO4)3溶液,铝离子的水解平衡正向移动,水解程度增大、溶液的酸性增强,正确。
考点:考查金属的腐蚀,化学反应方向,沉淀溶解平衡和盐类的水解。
本题难度:一般
3、选择题 下列现象不能用盐类水解知识解释的是
A.明矾能用于净水
B.泡沫灭火器的原理
C.铜绿的生成
D.配置FeCl2溶液时加入少量的盐酸
参考答案:C
本题解析:
A、明矾(即KAl(SO4)2)能用于净水,是由于Al3+的水解生成Al(OH)3胶体,能够吸附水中的悬浮颗粒,故A可用盐类水解知识解释;
B、泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,NaHCO3与Al2(SO4)3两种溶液分别水解呈碱性和酸性,可发生互促水解,生成二氧化碳气体和氢氧化铝沉淀,反应的离子方程式为3HCO3-+Al3+
本题难度:一般
4、填空题 (16分)Na2CO3俗称纯碱、苏打,NaHCO3俗称小苏打,两者在日常生活和工业生产中都有着广泛的应用。某化学兴趣小组设计了如下实验来探究两者的某些性质。请你根据所学知识帮他们完成有关的设计和实验。
(1)甲同学测定两者的酸碱性:各取一定量的固体溶于水,配成相同浓度的溶液,测定其pH值,测定结果为Na2CO3、NaHCO3的pH分别为a和b(a、b均大于7),则a b(填“大于”“等于”或“小于”),测定溶液的pH值所用的主要仪器有:pH试纸、表面皿、 和标准比色卡。
(2)有关①100mL0.1 mol·L-1NaHCO3、 ②100mL0.1 mol·L-1Na2CO3,两种溶液的叙述不正确是
A.NaHCO3溶液中:c (H+)+c (Na+)=" c" (HCO3-)+2c(CO32-)+c(OH-)
B.Na2CO3溶液中:2c (Na+)=" c" (HCO3-)+c(CO32-)+c(H2CO3)
C.①溶液中:c(CO32-)>c(H2CO3)
D.②溶液中:c(HCO3-)>c(H2CO3)
(3)乙同学取一定量的碳酸钠溶液于试管中,滴加2~3滴酚酞试液,发现溶液变红,继续滴加BaCl2溶液,预计可观察到 ,请你结合必要的离子方程式,应用平衡的观点解释有关现象的产生: 。
(4)丙同学往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl,当溶液中的:
c(Na+)=c(Cl-)+c(HCO3-)+2c(CO32-),此时溶液呈 (填“酸性”、“中性”或“碱性”),所用HCl的体积 10mL。(填“大于”“等于”或“小于”)
(5)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为 mol·L-1。
参考答案:21.(16分) (每空2分)
(1)大于 玻璃棒 (2)B C
(3)红色褪去,产生白色沉淀 ;由于Ba2+ +CO32-=BaCO3↓,使得溶液中CO32-浓度减少,水解平衡CO32- + H2O HCO3-+OH-向左移动,OH-浓度减少,红色褪去。
HCO3-+OH-向左移动,OH-浓度减少,红色褪去。
(4)中性 大于 (5)4.96×10-8
本题解析:(1)组成盐的酸根对应的酸越弱,该盐的水解程度越大,等浓度、等体积的Na2CO3和NaHCO3混合液中,碳酸根的水解程度大于碳酸氢根的水解程度,水解程度越大,碱性越强,PH越大,Na2CO3、NaHCO3的pH分别为a和b,则a大于b,测定溶液的pH值基本操作为用镊子撕一块试纸放在干净的表面皿上,用玻璃棒蘸取待测液,滴在试纸的中央,变色后与标准比色卡对比,读出PH值,则所用的主要仪器有:pH试纸、表面皿、玻璃棒和标准比色卡。
(2)A.NaHCO3溶液中存在电荷守恒,为c (H+)+c (Na+)=" c" (HCO3-)+2c(CO32-)+c(OH-),正确;B.Na2CO3溶液中存在物料守恒为c (Na+)=" 2c" (HCO3-)+2c(CO32-)+2c(H2CO3),错误;C.NaHCO3溶液显碱性,HCO3-水解程度大于其电离程度,水解产生H2CO3,电离产生CO32-,所以c(CO32-)<c(H2CO3) ,错误;D.碳酸钠溶液,阴离子分步水解,第一步水解程度(生成HCO3-)大于第二步水解程度(生成H2CO3),所以:c(HCO3-)>c(H2CO3),正确;选BC。
(3)由于CO32- + H2O  HCO3-+OH-,CO32-水解导致碳酸钠溶液显碱性,滴加酚酞试液,溶液变红色,继续滴加BaCl2溶液,发生Ba2+ +CO32-=BaCO3↓(白色沉淀),水解平衡逆向移动,碱性减弱,OH-浓度减少,红色褪去。
HCO3-+OH-,CO32-水解导致碳酸钠溶液显碱性,滴加酚酞试液,溶液变红色,继续滴加BaCl2溶液,发生Ba2+ +CO32-=BaCO3↓(白色沉淀),水解平衡逆向移动,碱性减弱,OH-浓度减少,红色褪去。
(4)任何溶液均呈电中性,根据电荷守恒,c(Na+)+c(H+)= c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-),已知溶液中存在c(Na+)= c(Cl-)+c(HCO3-)+2c(CO32-),所以c(H+)= c(OH-),此时溶液呈中性,往10mL0.10 mol·L-1的Na2CO3溶液中逐滴滴加0.10 mol·L-1的HCl10mL,溶液恰好反应生成NaHCO3,碳酸氢钠溶液显碱性,若要使溶液呈中性,需多加盐酸,所以所用HCl的体积大于10mL。
(5)将0.40 mol·L-1的Na2CO3溶液和0.20 mol·L-1的CaCl2溶液等体积混合,设体积为1L,发生反应Na2CO3 +CaCl2=CaCO3↓+2NaCl
0.2 0.2
剩余碳酸钠的物质的浓度为(0.4-0.2)/2=0.1mol/L,已知Ksp(CaCO3)=4.96×10-9,则0.1×c(Ca2+)= 4.96×10-9,解得c(Ca2+)= 4.96×10-8,则混合后溶液中Ca2+浓度为4.96×10-8mol·L-1。
考点:考查盐类水解PH值的判断,电解质溶液中的离子平衡,沉淀溶解平衡的应用等知识。
本题难度:困难
5、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (2)2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol
(3)50;抑制SnCl2水解 (4)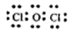 ;2HClO光照2H++2Cl-+O2↑
;2HClO光照2H++2Cl-+O2↑
(5)Al-3e-+4OH-=AlO2-+2H2O
本题解析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为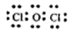 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学试题《与量有关的离子方.. | ||