微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图利用培养皿探究氨气的性质,实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面。下表中对实验现象的描述及所做的解释均正确的是

选项
| 实?验?现?象
| 解?释
|
A
| 浓盐酸附近产生白烟
| NH3与HCl反应生成了NH4Cl固体
|
B
| 浓硫酸附近无明显现象
| NH3与浓硫酸不发生反应
|
C
| 氯化铜溶液变白色浑浊
| 白色浑浊的成分是Cu(OH)2
|
D
| 湿润的红色石蕊试纸变蓝
| NH3是一种可溶性碱
|
?
参考答案:A
本题解析:A、向NaOH固体上滴几滴浓氨水,会产生氨气,与浓盐酸反应生成氯化铵,反应现象是有白烟生成,正确;B、向NaOH固体上滴几滴浓氨水,会产生氨气,与浓硫酸发生反应生成硫酸铵,错误;C、向NaOH固体上滴几滴浓氨水,会产生氨气,氨气与氯化铜溶液发生反应生成氢氧化铜蓝色沉淀,错误;D、氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成NH3?H2O,电子生成OH-离子,溶液呈碱性,但氨气为非电解质,不属于碱,错误。
本题难度:一般
2、选择题 下列叙述中,正确的是( )
A.二氧化硫具有漂白性,因而通入紫色石蕊试液中先变红后褪色
B.浓硫酸和浓硝酸在常温下均可迅速与铜片反应放出气体
C.浓硫酸与亚硫酸钠反应制备二氧化硫时,浓硫酸表现强氧化性
D.稀硫酸和稀硝酸都具有氧化性
参考答案:D
本题解析:二氧化硫的漂白原理是和有色物质化合生成不稳定所谓无色物质,所以SO2不能漂白酸碱指示剂,A不正确。浓硫酸需要在加热的条件下才能迅速和铜反应,B不正确。浓硫酸和亚硫酸钠反应制备SO2是利用了硫酸的酸性而不是强氧化性,因为该反应不属于氧化还原反应,C错误。所以正确的答案是D。
本题难度:一般
3、填空题 氨在国民经济中占有重要地位。
(1)NH3的电子式为?
(2)实验室中制取氨气的化学方程式为?,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因?;
溶液中离子浓度由大到小的顺序为?
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:?
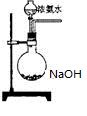
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式?;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 ?
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式?。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________
参考答案:(1)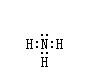 (1分)
(1分)
(2)2NH4Cl +Ca(OH)2 CaCl2+2NH3 ↑+2H2O?(2分)NH4++H2O
CaCl2+2NH3 ↑+2H2O?(2分)NH4++H2O NH3·H2O+H+(1分)
NH3·H2O+H+(1分)
c(Cl-) >c(NH4+) >c(H+)> c(OH-)?(1分)
(3) NH3+H2O NH3·H2O
NH3·H2O NH4++OH-?
NH4++OH-?
NaOH溶于水发生电离,使c(OH-)增大,平衡向生成NH3的方向移动,NH3逸出(2分)
(4) 2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+?(1分)? (答案合理即给分)
3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+(1分)? (答案合理即给分)
(5)N2H4- 4e—+ 4OH—?=N2+4H2O?(2分)
(6)3O2 + 2NO + 6NO2 + 4Ca(OH)2=4Ca(NO3)2? +? 4H2O? (2分)
本题解析:(1)N原子分别与3个H原子形成一对共用电子,电子式为: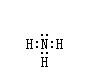
(2)实验室用Ca(OH)2与NH4Cl制取NH3,化学方程式为:2NH4Cl +Ca(OH)2 CaCl2+2NH3 ↑+2H2O;生成的产物为NH4Cl,水解显酸性,离子方程式为:NH4++H2O
CaCl2+2NH3 ↑+2H2O;生成的产物为NH4Cl,水解显酸性,离子方程式为:NH4++H2O 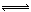 NH3?H2O+H+;NH4+水解浓度小于Cl?,溶液显酸性则H+浓度大于OH?浓度,所以c(Cl-) >c(NH4+) >c(H+)> c(OH-)。
NH3?H2O+H+;NH4+水解浓度小于Cl?,溶液显酸性则H+浓度大于OH?浓度,所以c(Cl-) >c(NH4+) >c(H+)> c(OH-)。
(3)氨水中存在平衡:NH3+H2O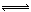 NH3·H2O
NH3·H2O 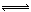 NH4++OH-,NaOH溶于水发生电离,使c(OH-)增大,并且溶解时放热,平衡向生成NH3的方向移动,NH3逸出。
NH4++OH-,NaOH溶于水发生电离,使c(OH-)增大,并且溶解时放热,平衡向生成NH3的方向移动,NH3逸出。
(4)SO2、H2O、NH3反应可生成SO32?,SO32?与Ba2+结合生成BaSO3沉淀,离子方程式为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+ ;SO2被NO3?、H+氧化为SO42?,SO42?与Ba2+结合生成BaSO4沉淀,离子方程式为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+。
(5)N2H4在碱性条件下失电子生成N2和H2O,配平可得电极方程式:N2H4- 4e—+ 4OH—?=N2+4H2O。
(6)n(NO):n(NO2)=1:3,则方程式中NO与NO2的系数为1:3,可得化学方程式:3O2 + 2NO + 6NO2 + 4Ca(OH)2=4Ca(NO3)2? +? 4H2O。
本题难度:困难
4、选择题 白磷和红磷在一定条件下可以相互转化,这一变化属于(?)
A.物理变化
B.化学变化
C.氧化还原反应
D.非氧化还原反应
参考答案:BD
本题解析:有新物质生成,但无化合价变化。
本题难度:简单
5、选择题 科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法不正确的是(?)
A.N4和N2互为同素异形体
B.14N与14C互为同位素
C.N4H4(SO4)2不能与草木灰混合使用
D.8NH3+ 4C5OH=N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子
参考答案:B
本题解析:N4与N2都是N元素的单质,A对;14N与14C是不同元素的原子,B错;草木灰水解显碱性,N4H4(SO4)2中的N4H44+在碱性条件下生成N4分子不能被植物吸收,C对;8NH3+4C5OH=N4+4C5NH2+6H2+4H2O反应中4 mol NH3反应生成1 mol N4,转移电子的物质的量为12 mol,生成0.1 mol N4转移电子的物质的量为1.2 mol,D对。
本题难度:一般