微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)下图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线,试回答:
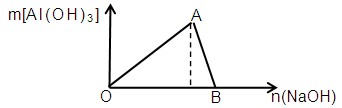
(1) A点时已参加反应的AlCl3和NaOH的物质的量之比是
(2) OA段曲线所表示的反应的离子方程式是
(3) AB段曲线所表示的反应的离子方程式是
(4) B处溶液中存在的浓度最大的离子是 (填离子符号)。向B处于生成的溶液中通入CO2,可见到的现象是
参考答案:(7分)
⑴ 1:3(1分)
⑵ Al3++3OH-==Al(OH)3↓(2分)
⑶ Al(OH)3+OH
本题解析:
本题难度:一般
2、选择题 中和相同体积、相同pH的硫酸、盐酸和醋酸三种稀溶液,所用相同浓度的NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系为(? )?
A.V3>V2>V1
B.V3=V2>V1?
C.V3>V2=V1
D.V1=V2>V3
参考答案:C
本题解析:略
本题难度:简单
3、填空题 (Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验
编号
| HA的物质的量浓度(mol·L-1)
| NaOH的物质的量浓度(mol·L-1)
| 混合后溶液的pH
|
甲
| 0.1
| 0.1
| pH=a
|
乙
| 0.12
| 0.1
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=10
|
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
参考答案:(1)a=7时,HA是强酸;a>7时,HA是弱酸
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-4-10-10
(5)A、C
本题解析:(1)一元酸HA与NaOH等物质的量反应,酸性强弱取决于完全中和后盐的pH,a=7为强酸,a>7为弱酸;
(2)根据电荷守恒,有c(Na+)+c(H+)=c(A-)+c(OH-),因c(H+)=c(OH-),所以c(Na+)=c(A-);
(3)丙为等浓度的HA与NaA的混合溶液,由pH>7知A-水解程度大于HA的电离,离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+);
(4)据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),推导c(Na+)-c(A-)=c(OH-)-c(H+)=10-4-10-10;
(5)注意题干中的电离方程式,判断A项为B元素的物料守恒,C项为溶液中的质子守恒。
本题难度:困难
4、填空题 (14分)(1)常温下物质的量浓度相同的aHF、bNH3·H2O、c H2S溶液,电离常数分别为7.2
参考答案:
本题解析:
本题难度:一般
5、选择题 下列对溶液pH的有关判断中,正确的是( )
A.随着温度的升高,Na2CO3溶液pH减小
B.随着温度的升高,纯水的pH增大
C.向0.1mol?L-1的CH3COOH溶液中加入少量CH3COONa晶体,溶液的pH增大
D.pH=2的醋酸溶液与pH=2的H2SO4溶液的物质的量浓度之比为2:1
参考答案:A、碳酸钠中碳酸根的水解反应方程式:CO32-+H2O?HCO3-+OH-,水解过程是吸热的,温度越高弱酸根离子的水解程度越大,随着温度的升高,水解平衡向右移动,氢氧根浓度增大,碱性增强,pH增大,故A错误;
B、温度越高越有利于水的电离,水的离子积常数越大,氢离子浓度越大,pH减小,故B错误;
C、CH3COOH溶液中加入少量CH3COONa晶体,CH3COO-对醋酸的电离起抑制作用,所以酸性减弱,溶液的pH增大,故C正确;
D、醋酸是弱电解质,不完全电离,pH=2的醋酸溶液其浓度大于0.01mol/L,H2SO4是强酸,能完全电离,pH=2的H2SO4溶液的物质的量浓度为0.005mol/L,比值大于2:1,故D错误.
故选C.
本题解析:
本题难度:简单