微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5?mol·L-1、2?mol·L-1、18.4?mol·L-1)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:?

(1)甲同学表中实验步骤②为__________________
(2)甲同学的实验目的是__________________要得出正确的实验结论,还需控制的实验条件是__________________
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是______________________
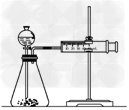
(4)乙同学完成该实验应选用的实验药品是________________该实验中不选用某浓度的硫酸,理由是________________________
参考答案:(1)分别投入大小、形状相同的Cu、Fe、Al
(2)研究金属(或反应物)本身的性质与反应速率的关系;温度相同
(3)一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)Fe(或Al)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;常温下Fe(或Al)在18.4 mol·L-1硫酸中钝化
本题解析:
本题难度:一般
2、实验题 某兴趣小组拟利用如下图装置探究验证干燥的Cl2和潮湿的Cl2有无漂白性。 ? 回答下列问题:

(1)A装置中的主要玻璃仪器有:导管、酒精灯、圆底烧瓶、__________。 A装置中发生反应的化学方程式是____________。 F装置中的试剂应为____________,作用为___________。
(2)按气体从左向右流向将各装置依次连接起来(填接口标号):?a?接_________,?_______接______,______接_______?,_______接_______,_______接________。
(3)通入Cl2后,从集气瓶A、B中红色布条的现象可得出的结论是__________?;其中发生的反应的化学方程式为_______________。
(4)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是___________。
(5)烧杯E中发生反应的化学方程式为______________。
(6)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛4?mol·L-1的NaOH溶液的体积至少应为___________mL。
参考答案:(1)分液漏斗;MnO2+4HC(浓)===MnCl2+2H2O+Cl2↑?;饱和食盐水;除Cl2中的HCl
(2)a?接i,j接g,f接e,d接b,c接h?
(3)干燥的Cl2没有漂白性,氯水有漂白性?;Cl2+?H2O=HCl+?HClO
(4)验证稀盐酸是否有漂白性
(5)吸收多余的Cl2?; Cl2+2NaOH=NaCl+?NaClO+H2O
(6)100
本题解析:
本题难度:一般
3、实验题 (12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为?;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:?
?。
⑵过程I加入铁屑的主要作用是_______?;从固体中分离出铜需采用的方法是_________?。
⑶过程II中发生主要反应的化学方程式为:_____?,?。
参考答案:⑴2Fe3++Cu=2Fe2++Cu2+?取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+ (合理即得分)
⑵回收铜 加盐酸反应后过滤?
⑶FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (每空2分)
本题解析:(1)对离子方程式的书写,应注意配平。该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。检验铁离子的存在应用KSCN溶液。注意语言的描述“取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明仍存在Fe3+”
(2)加入铁屑的主要目的是除去铜离子,回收铜单质。因铜不溶于酸溶液,因此可滴加稀盐酸,使多余的铁反应,从而得到铜单质。
(3)过程Ⅱ加入了石灰水,同时还鼓入了空气,因此发生的反应为FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题主要考查了金属的相关性质及其化学方程式的书写。书写化学方程式时,应注意化学方程式的配平。
本题难度:一般
4、简答题 某学生设计了如下实验:

回答下列问题:
(1)该同学的实验目的是______;
(2)上图括号内的操作步骤均为______;
(3)按此实验方案得到的NaCl固体中肯定含有______?(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______;
(4)写出生成B的离子方程式______.
参考答案:(1)混合物A溶于水得到CaCl2和NaCl溶液,经过实验操作后得到CaCl2和NaCl,则实验目的是分离CaCl2和NaCl两种固体混合物,故答案为:分离CaCl2和NaCl两种固体混合物;
(2)由溶液得到固体应用蒸发的操作分离,一般操作为蒸发浓缩、冷却结晶,故答案为:蒸发;
(3)溶液加过量Na2CO3溶液,生成CaCO3沉淀,过滤得到CaCO3沉淀与NaCl和Na2CO3的混合溶液,加入盐酸,蒸发可得到NaCl固体,
故答案为:Na2CO3;稀盐酸;
(4)溶液加过量Na2CO3溶液,生成CaCO3沉淀,发生反应的离子方程式为Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓.
本题解析:
本题难度:一般
5、实验题 某化学小组用环己醇制备环己烯

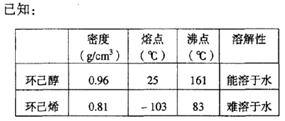
制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在?层(填上或下),分液后用??(填入编号)洗涤。
a.KMnO4溶液? b.稀H2SO4? c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 ?口进入。蒸馏时要加入生石灰,目的是?。
?口进入。蒸馏时要加入生石灰,目的是?。

③收集产品时,控制的温度应在?左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(?)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
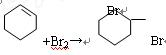
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式?。
参考答案:(1)①上、C?②g、吸收水?③83℃、C
(2)
本题解析:略
本题难度:简单