微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 利用右图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中.请回答:
| 实验试剂 | 实验结论
甲
乙
丙
①
高锰酸钾
②
氧化性:KMnO4>Cl2>Br2
|
(1)图中①为______,②为______,
(2)请你根据上述实验装置设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表:
| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论
______
______
______
______
______
|
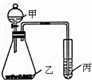
参考答案:解;(1)依据实验装置图可知,甲和乙反应,生成产物通入丙中反应,如证明氧化性:KMnO4>Cl2>Br2,需要根据氧化还原反应的氧化剂的氧化性大于氧化产物的规律分析判断,甲为浓盐酸,滴入高锰酸钾溶液中生成氯气,氯气通入溴化钠溶液中会反应生成溴单质;高猛酸钾做氧化剂氧化盐酸中的氯化氢为氯气,氯气把氧化溴化钠中的溴离子为溴单质,符合氧化剂的氧化性大于氧化产物的规律应用,故答案为:浓盐酸;溴化钠溶液;
(2)实验证明盐酸>碳酸,利用酸性强弱规律设计实验,盐酸和大理石反应生成二氧化碳气体,使澄清石灰水变浑浊或通入硅酸钠溶液生成白色沉淀;分液漏斗中的稀盐酸滴入盛大理石的锥形瓶中,反应生成二氧化碳气体,利用丙 装置检验二氧化碳的生成,证明盐酸酸性大于碳酸,试剂甲为稀盐酸,试剂乙为石灰石,试剂丙为澄清石灰水或硅酸钠溶液,丙中现象为澄清石灰水变浑浊或硅酸钠溶液变浑浊,证明盐酸酸性大于碳酸大于硅酸,
故答案为:
试剂甲试剂乙试剂丙丙中现象实验结论盐酸石灰石澄清石灰水或硅酸钠变浑浊酸性为:盐酸>碳酸,或盐酸>碳酸>硅酸
本题解析:
本题难度:一般
2、实验题 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

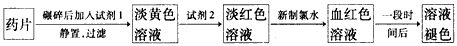
(1)试剂l是______________,试剂2是_______________,加入新制氯水后溶液中发生的离子反应方程式是_____________________________。
(2)加入试剂2后溶液中颜色由淡黄色转变为淡红色是因为__________________________;写出+2价Fe在空气中转化为+3价Fe的离子方程式___________________________。
(3)该同学猜想血红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?________________________________。若你认为合理,请说明理由(若你认为不合理,该空不要作答)________________________; 若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答): _______________________。
参考答案:(1)稀盐酸;KSCN溶液;2Fe2++Cl2=2Fe3++2Cl-
(2)Fe3++SCN-=[Fe(SCN)]2+4Fe2++4H++O2=4Fe3++2H2O
(3)不合理;可能是SCN-被过量的氯水氧化,在褪色后溶液中加入FeCl3溶液,仍不变红色(或在褪色后溶液中加入KSCN溶液,变红色)
本题解析:
本题难度:一般
3、实验题 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5 mL浓FeCl3溶液于试管中,逐滴加入浓Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,继续加入浓Na2SO3溶液至过量,溶液颜色加深,最终变为红褐色液体。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了以上观察到的现象外,该小组成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为
_____________________。研究性学习小组设计两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应;
方案二:检验溶液中含有___________证明发生了氧化还原反应。
实验用品:0.1 mol/L BaCl2溶液、3 mol/L盐酸、0.1 mol/L KMnO4(H+)溶液、氯水、20% KSCN溶液、0.5 mol/L KI溶液,试管若干、胶头滴管若干
(3)预处理:将(1)中获得的混合物放在如下图装置中处理足够时间。
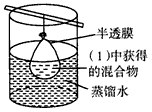
检验过程:

参考答案:(1)Fe(OH)3胶体
(2)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;SO42-(3)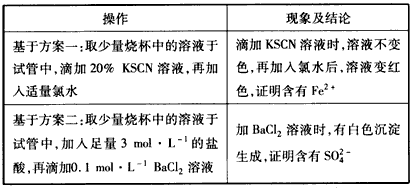
本题解析:
本题难度:一般
4、实验题 过氧化钙(CaO2)常用作种子消毒剂、药物制造、?油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体?生成。有人提出:CO2、SO2与过氧化?钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断?。
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:?
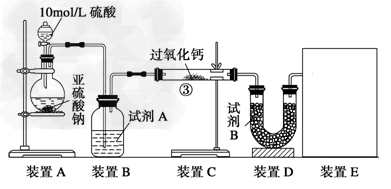
(1)试剂A可以选用____________,试剂B为碱石灰其作用是______________________。
(2)装置E用于测定氧气?的体积?,请在框中画出装置图。
(3)实验测得装?置C增重m1?g,装置D增重m2?g,装置E中收集到V?L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。若SO2完全氧化,写出反应的化学方程式:__________________________。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
假设2:反应后固体中只有Na2SO4,SO2完全氧化;
假设3?:________________________。
实验探究:
(4)设计实验证明假设3是正确的,简要回答实验过程、现象和结论:________________ ________________________________。
实?验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因: _______________________________________。?
参考答案:(1)浓硫酸 ;吸收未反应的SO2
(2)? (其它合理答案均可)
(其它合理答案均可)
(3)?V=7m1/30 ; CaO2+SO2===CaSO4? ;反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生。再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化。
(5)若Na2O2剩余,固体加水溶解,过氧化钠能将SO32-氧化成SO42-。
本题解析:
本题难度:一般
5、实验题 为证明化学反应有一定的限度,进行如下探究活动:
I.取5 mL 0.1 mol/L的KI溶液,滴加5~6滴稀FeCl3溶液;
Ⅱ.继续加入2 mL CCl4溶液,振荡;
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_______________ 探究活动Ⅱ的实验现象为________________
(2)探究活动Ⅲ的目的是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+; 猜想二:生成的Fe(SCN)3溶液浓度极小,无法用肉眼观察其颜色。为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中的大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN高。 结合新信息,现设计以下实验方案验证猜想:
①请完成下表:

②写出实验操作“方案一”中反应的离子方程式:_______________。
Ⅳ.为了测定探究活动I中的稀FeCl3溶液的浓度,现进行以下操作:
(3)移取25.00 mL稀FeCl3溶液至锥形瓶中,加入__________作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是____________________。
(4)重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则稀FeCl3溶液中溶质的物质的量浓度为_______
mol/L。
参考答案:(1)液体呈棕褐色;溶液分层,下层四氯化碳层呈紫色 (2)①  ②4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓
②4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓
(3)KSCN溶液;当滴加最后一滴KI标准溶液时,红色褪去且半分钟内不恢复
(4)0.04cV
本题解析:
本题难度:一般