微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某容积可变的密闭容器中盛有足量的A,通人气体B,发生反应:
A(s)+3B(g) 2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
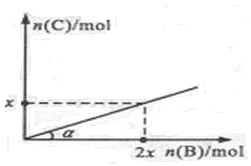
A若保持压强不变,降低温度时,图中角度a将变小
B若增大压强,缩小容器的体积,平衡向正反应方向移动
C若保持压强不变,再通人B,则再次达到平衡时正、逆反应速率均增大
D平衡时B、C的物质的量之比为1:2
参考答案:D
本题解析:
A中降低温度,平衡正向移动,所以通入相同的量B,生成的C更多,a增大,A错;该反应为体积不变的反应,增大压强,平衡不移动,B错;恒压的条件下,通入B,为等效平衡,达到平衡,正逆反应速率不变,C错;从图像中可以看出,比值1:2,D正确;答案选D。
本题难度:一般
2、选择题 可逆反应2NH3 N2+3H2在密闭容器中进行,达到平衡状态的标志是(?)
N2+3H2在密闭容器中进行,达到平衡状态的标志是(?)
①单位时间内生成n mol N2的同时生成2n mol NH3? ②单位时间内生成n mol N2的同时生成3n mol H2? ③用NH3、N2、H2的物质的量浓度变化表示的反应速率之比为2∶1∶3? ④各气体的浓度不再改变? ⑤混合气体的平均相对分子质量不再改变?
A.①④⑤
B.②③⑤?
C.①③④
D.①②③④⑤?
参考答案:A
本题解析:可逆反应2NH3 N2+3H2两边的气体系数不相等,在达到平衡时,各物质的浓度、总物质的量、平均相对分子质量不再改变,可做为平衡判断的标准;平衡状态的本质是正逆反应速率相等,①符合题意,而②只表明了正反应速率,排除;③是反应过程中一个特殊状态,并不能表明达到平衡状态。
N2+3H2两边的气体系数不相等,在达到平衡时,各物质的浓度、总物质的量、平均相对分子质量不再改变,可做为平衡判断的标准;平衡状态的本质是正逆反应速率相等,①符合题意,而②只表明了正反应速率,排除;③是反应过程中一个特殊状态,并不能表明达到平衡状态。
本题难度:一般
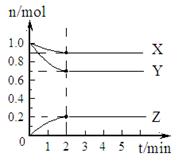
3、计算题 (6分)(1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。分析有关数据,写出X、Y、Z反应的化学方程式?。
(2)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中的化学方程式进行反应,当达到化学平衡时,测得Z的物质的量分数为25%,求平衡时X的转化率。
参考答案:(1)X+3Y 2Z (用“=”不给分)(2分)
2Z (用“=”不给分)(2分)
(2)? X? +? 3Y 2Z
2Z
起始量(mol)? 2? 3? 0
转化量(mol)? a? 3a? 2a
平衡量(mol)? 2-a? 3-3a? 2a
所以有
解得a=0.5
所以其转化率是 =25%。
=25%。
本题解析:(1)根据图像可知X和Y是反应物,Z是生成物,反应进行到2min是各种物质的物质的量不再发生变化,X、Y。Z物质的量的变化量分别为0.1mol、0.3mol、0.2mol,所以方程式为X+3Y 2Z。
2Z。
(2)可采用三段式进行计算。
本题难度:一般
4、选择题 若15 gA物质与10.5 gB物质恰好完全反应,生成9 gC物质量和0.3 molD物质,则D物质量的摩尔质量是
A.55 g
B.55 g/mol
C.111 g/mol
D.27.5 g/mol
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。
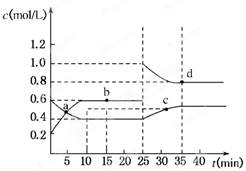
下列推理分析合理的是
A.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min)
B.反应进行到10 min时,体系吸收的热量为9.68 kJ
C.a、b、c、d四点中v正与v逆均相等
D.25 min时,导致平衡移动的原因是升温
参考答案:B
本题解析:略
本题难度:一般