微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题:
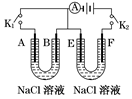
(1)打开K2,闭合K1,B为_______极,A的电极反应为_____,最终可观察到的现象是?。
(2)打开K1,闭合K2,E为_______极,检验F极产生气体的方法是?。该装置中发生反应的化学方程式为_________。
(3)若往U型管中滴加酚酞,进行(1)、(2)操作时,?极周围能变红(填A、B、E、或F)。
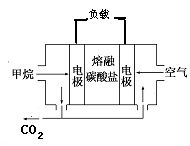
(4)若电源选用燃料电池,结构如下图,以熔融碳酸盐为电解质(非水溶济,能够传导CO32-),电池工作时电解质组成保持稳定,通入甲烷的电极为________极,请写出正极反应的方程式?,若在标况下消耗11.2L的甲烷,电解NaCl溶液产生的H2的物质的量为?mol(假设燃料电池能量转化率为75%)。
参考答案:(1)负;(2分)O2+2H2O+4e-===4OH-;(2分)溶液中有红褐色沉淀生成(2分)(2)阴;(2分)用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,
证明是氯气(2分)2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)(3)A、E;(4分)
2NaOH+H2↑+Cl2↑(2分)(3)A、E;(4分)
(4)负(2分)? 2CO2+O2+4e-=2CO32-(2分);1.5(3分)
本题解析:(1)打开K2,闭合K1,则构成原电池,铁是负极,即B是负极,A是正极。此时发生铁的吸氧腐蚀,所以最终溶液中有红褐色氢氧化铁沉淀生成。
(2)打开K1,闭合K2,则构成电解池。E和电源的负极相连,作阴极,溶液中的氢离子放电。F和电源的正极相连,是阳极,溶液中的氯离子放电生成氯气。氯气具有氧化性,可用湿润的淀粉碘化钾试纸检验。
(3)根据以上分析可知,进行(1)、(2)操作时,OH-分别在A和E极产生,所以在这两极溶液显红色。
(4)原电池中负极失去电子,发生氧化反应,甲烷在反应中被氧化,失去电子,所以在负极通入,空气在正极通入。由于电解质是熔融盐,能传递能够传导CO32-,所以正极的电极反应式为2CO2+O2+4e-=2CO32-。1mol甲烷在反应中失去8mol电子,11.2L甲烷是0.5mol,共转移电子4mol。根据得失电子守恒可知生成氢气是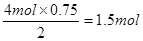 。
。
本题难度:一般
2、选择题 如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
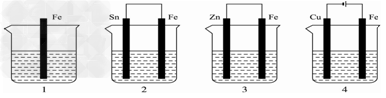
A.4>2>1>3
B.2>1>3>4?
C.4>2>3>1
D.3>2>4>1?
参考答案:A
本题解析:
本题难度:简单
3、选择题 生活中常见的金属防腐的方法很多.下列措施不能起到防腐作用的是( )
A.健身器材刷油漆
B.衣架和电线的外面包上一层塑料层
C.地下钢铁管道连接镁块
D.在轮船船身上装上一定数量的铜块
参考答案:A、健身器材刷油漆为外加防护膜的保护法,可以隔绝空气,所以能起到防腐作用,故A不选;
B、衣架和电线的外面包上一层塑料层为外加防护膜的保护法,可以隔绝空气,所以能起到防腐作用,故B不选;
C、地下钢铁管道连接镁块,金属镁比铁活泼,属于牺牲阳极的阴极保护法,所以能起到防腐作用,故C不选;
D、在轮船船身上装上一定数量的铜块,铁比铜活泼,加快了铁的腐蚀,所以不能起到防腐作用,故D选;
故选D.
本题解析:
本题难度:一般
4、填空题 完成下列表格的填写