微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表是元素周期表的一部分,有关说法正确的是
族
周期
| IA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
|
2
| ?
| ?
| ?
| c
| ?
| d
| ?
|
3
| a
| b
| ?
| ?
| ?
| e
| f
|
?
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素组成的单质和氧化物都是原子晶体
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
参考答案:D
本题解析:A、d和e属于同一主族,由上到下,元素非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,即H2O>H2S,故A错;B、a、b、e属于同一周期,从左到右核电荷数依次增多,原子半径逐渐减小,因此a、b、e三种元素的原子半径大小为a>b>e,故B错;C、碳元素构成的单质如碳-60是分子晶体,故C错;D、同一周期中,从左到右核电荷数依次增多,原子得电子能力逐渐增强,同一主族,由上到下,原子得电子能力逐渐减弱,因此c、e、f的最高价氧化物对应的水化物酸性增强,故D对;故选D。
本题难度:一般
2、填空题 在①35Cl、②37Cl—、③12C、④23Na+、⑤24Mg2+、⑥14C中;(用序号回答下列问题)
(1)粒子半径比较:①_____②;④_____⑤(填 < = > 号)
(2)微粒中质子数等于中子数的是____________,核外电子数相等的微粒______ ______;
(3)_________与_________互为同位素,共有___________种元素。
参考答案:(8分)(1)<?> (2) ③⑤;③与⑥、④与⑤?(3)③与⑥;4种
本题解析:(1)同种元素的原子半径小于阴离子半径,则微粒半径是①<②;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则微粒半径是④>⑤。
(2)由于质子数+中子数=质量数,所以微粒中质子数等于中子数的是③⑤分别都是6和12;核外电子数相等的微粒③与⑥、④与⑤,核外电子数分别是6和10。
(3)质子数相同,中子数不同的同一种元素的不同核素互称为同位素,所以③与⑥互为同位素。元素的种类是由质子数决定的,则共计有4中元素。
点评:该题是常识性知识的考查,难度不大。试题基础性强,紧扣教材,旨在巩固学生的基础,提高学生的应试能力和学习效率。
本 题难度:简单
3、填空题 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
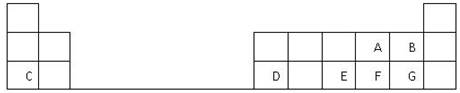
(1)画出A的原子结构示意图__________。
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(3)D在元素周期表中的位置是第3周期第________族。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式________________________。
(6)A、C、D 的离子半径大小关系是___________________ (用离子符号表示)?
参考答案:
(12分,各2分)
(1)氧原子结构示意图?(2分)(2)PH3?(2分)
(3)ⅢA?(2分)(4)H2SO4 ?(2分)
(5)硫化钠的电子式?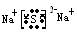 (2分)
(2分)
(6)O2-> Na+>Al3+或Al3+< Na+<O2-?(2分)
本题解析:略
本题难度:一般
4、选择题 下列叙述中,甲金属一定比乙金属活泼性强的是:(?)
A.甲原子电子层数比乙原子的电子层数多
B.在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极
C.1mol 甲和乙分别与足量的盐酸反应,产生H2的量:甲>乙
D.常温时,甲能从水中置换出氢,而乙不能
参考答案:D
本题解析:如金属不位于同一主族,例如Na和Cu,不能根据电子层数的多少来判断金属的活泼性强弱,故A错误;在甲乙两种金属和盐酸构成的原电池中,甲作正极,乙作负极,说明乙活泼,故B错误;产生氢气的多少取决于金属失去电子数的多少,与金属的活泼性无关,故C错误;金属的活泼性越强,越易与水反应,所以常温时,甲能从水中置换出氢,而乙不能可以说明甲金属一定比乙金属活泼性强,故D为本题的答案。
点评:本题考查了金属活动性的比较,该考点是考点的常考考点,本题侧重对学生基础知识的考查,本题难度不大。
本题难度:一般
5、选择题 下列判断中一定正确的是
A.若R2-和M+的电子层结构相同,则原子序数:R>M
B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
C.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
D.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强
参考答案:D
本题解析:A、若R2-和M+的电子层结构相同,则离子的核外电子数相同。由于前者是阴离子,质子数=核外电子数-2,后者是阳离子,质子数=核外电子数+1,所以原子序数:R<M,A不正确;B、一般情况下,氢化物的相对分子质量越大,沸点越高。但由于HF、H2O以及NH3分子中存在氢键,因此沸点高于同主族元素氢化物的沸点,B不正确;C、同主族自上而下,非金属性逐渐减弱,因此若M、N是同主族元素,且原子序数:M>N,则非金属性:M<N,C不正确;D、同主族自上而下金属性逐渐增强,相对原子质量逐渐减小,所以若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y的强,D正确,答案选D。
本题难度:一般