微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 生活中的下列现象与原子核外电子发生跃迁无关的是(?)
A.焰色反应
B.节日里燃放的焰火
C.金属导线可以导电
D.夜空中的激光
参考答案:C
本题解析:电子跃迁本质上是组成物质的粒子(原子、离子或分子)中电子的一种能量变化。根据能量守恒原理,粒子的外层电子从低能级转移到高能级的过程中会吸收能量;从高能级转移到低能级则会释放能量,所以选项ABD都是和电子的跃迁有关系的。金属导电,是自由电子的定向运动,与电子的跃迁无关系,答案选C。
本题难度:简单
2、选择题 下列各组元素中,原子半径依次增大的是:(?)
A.? I、Br、Cl? B.? Al、Si、P? C.? O、S、Na? D.? C、N、B
参考答案:C
本题解析:A.? I、Br、Cl是同一主族的元素,由于原子核外电子层数逐渐减小,所以原子半径逐渐减小。错误。B.? Al、Si、P是同一周期的元素,由于原子序数逐渐增大,因此原子半径逐渐减小。错误。C.? O、S是同一主族的元素,由于原子核外电子层数S比O多,所以原子半径S>O;Na、S是同一周期的元素,由于所以序数S大于Na,原子序数越大,原子半径就越小,因此原子半径Na>S。故这三种元素的原子半径关系为:O< S <Na。正确。? D. 这三种元素是同一周期的元素。由于原子序数B< C<N,原子序数越大,原子半径就越小。故原子半径关系为B>C>N。 错误。
本题难度:一般
3、选择题 下列元素中,金属性最强的是
A.锂
B.钠
C.钾
D.铷
参考答案:D
本题解析:四种元素都是碱金属,碱金属自上而下金属性逐渐增强,所以金属性最强的是铷,答案选D。
点评:该题是基础性试题考查,主要是考查学生对元素金属性确认比较的熟悉了解程度,旨在培养学生的逻辑推理能力,难度不大,记住元素周期律,灵活运用即可。
本题难度:简单
4、计算题 某元素的核素为 X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
(1)计算X的质量数为多少?
(2)指出X元素在周期表中的位置。
参考答案:(1)40 (2)第4周期 第ⅡA族
本题解析:n(Cl-)=n(Ag+)=1 mol·L-1×20×10-3 L=0.020 mol;所以n(XCl2)=0.010 mol;M(XCl2)=111 g·mol-1,M(X)=111 g·mol-1-71 g·mol-1=40 g·mol-1;易得X的相对原子质量为40,所以质量数也为40,又知X核素中含20个中子,故质子数为40-20=20,即为钙(Ca)。
本题难度:简单
5、选择题 下图中,能正确表示基态硅原子的是?(?)
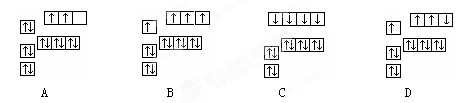
参考答案:A
本题解析:Si是14号元素,其基态核外电子排布式是1s22s22p63s23p2。原子核外的电子总是尽可能的成单排列,这样原子的能量较低,比较稳定。因此其基态核外电子图为A。
本题难度:一般