微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知下列元素的半径为:
原子
| N
| S
| O
| Si
|
半径r/10-10m
| 0.75
| 1.02
| 0.74
| 1.17
|
根据以上数据,磷原子的半径可能是:
A.1.10×10-10m?B.0.80×10-10m?C.1.20×10-10m?D.0.70×10-10m
参考答案:A
本题解析:考查元素周期律的应用。同周期元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大。所以P的原子半径大于N的,也大于S的,但要小于Si的,即选项A正确。答案是A。
本题难度:简单
2、填空题 (13分)Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。W是短周期元素,最外层电子数是最内层电子数的三倍,吸引电子对的能力比X单质的组成元素要弱。
(1) Z的化学式__________________
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别Y和二氧化硫的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比W单质氧化性强(仅用一个化学方程式表示):_____________。
Ⅱ.如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。
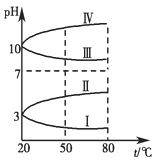
(1)其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),
(2)20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________。(计算精确值)
(3)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
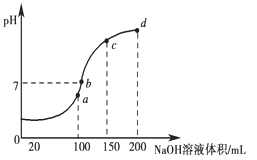
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________
参考答案:Ⅰ.(1)O2(2分)
(2)加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3(2分)
(3) H2S+Cl2====S+2HCl(1分)(其他合理答案均可)
Ⅱ.(1)Ⅰ(2分)
(2)(10-3-10-11)mol·L-1?(2分) (3)a(2分) c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) (2分)
本题解析:I:首先根据信息确定X为Cl2,R为氧元素,Y为O3,Z为O2,W为硫元素。O3因具有强氧化性使品红褪色,与SO2不同,故对褪色后的溶液进行加热,若溶液恢复红色,则原通入气体为SO2;若溶液不变红,则原通入气体是O3;能说明Cl2的氧化性比S的氧化性强的反应有H2S+Cl2====S+2HCl,K2S+Cl2====S+2KCl等。
Ⅱ⑴NH4Al(SO4)2中NH4+、Al3+发生水解使溶液显酸性(pH<7),且温度升高,促进水解,酸性增强,pH减小,曲线Ⅰ正确。
⑵据NH4Al(SO4)2溶液中的电荷守恒式为2c(SO42-)+ c(OH-)=c(H+)+c(NH4+)+3c(Al3+),则2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+) -c(OH-)=(1×10-3-1×10-11)mol·L-1;
⑶在a点两物质恰好反应生成(NH4)2SO4,NH4+发生水解,水的电离程度最大;在b点[在a点(恰好生成(NH4)2SO4)之后再稍多加一点NaOH,使少量NH4+与OH-反应生成NH3·H2O,即c(Na+)>c(SO42-)>c(NH4+)],又根据溶液为中性,故有c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
本题难度:困难
3、选择题 在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3一定是离子化合物
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y一定属于同一周期
D.X和Y一定不属于同一主族
参考答案:B
本题解析:可能是+3价的B或Al与-1价的F或Cl组成的BF3、BCl3、AlCl3、AlF3,也可能是+6价的S与-2价的O组成的SO3。所以,两种元素可能位于同一周期,也可能不在同一周期;可能在同一主族,也可能不在同一主族;可能是分子晶体,也可能是离子晶体(AlF3);原子序数之差可能为4、6、8、12。.
本题难度:一般
4、选择题 下列说法不符合ⅦA族元素性质特征的是
A.易形成-1价离子
B.从上到下原子半径逐渐减小
C.从上到下非金属性逐渐减弱
D.从上到下氢化物的稳定性依次减弱
参考答案:B
本题解析:ⅦA族元素原子最外层都是7个电子,易形成-1价离子到达稳定结构,A正确;从上到下原子的电子层数增多,半径逐渐增大,B不正确;从上到下半径逐渐增大,吸引电子能力逐渐降低,非金属性逐渐减弱,C正确;从上到下非金属性逐渐减弱,氢化物的稳定性依次减弱,D正确。
本题难度:一般
5、选择题 除去CO2中混有少量的SO2,最好选用的试剂是
A.饱和苏打溶液
B.品红溶液
C.氯水
D.饱和小苏打溶液
参考答案:D
本题解析:正确答案:D
A、不正确,CO2+Na2CO3+H2O=2NaHCO3;B、品红溶液只能检验SO2;C、Cl2容易逸出;D、正确,SO2+NaHCO3=CO2+NaHSO3
本题难度:困难