微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )
A.所有分子中都存在共价键
B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力大小有关
C.第VIA族元素的气态氢化物H2O、H2S、H2Se的熔沸点依次升高
D.只要是离子化合物,其中就一定还有金属元素
2、填空题 【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是?(填元素符合),写出基态Fe原子的核外电子排布式?。
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有?,在右图的方框内用“→”标出Fe2+的配位键。
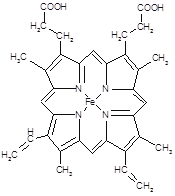 ?
?
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g)?△H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的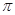 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式?,1 mol O22+中含有的π键数目为?。
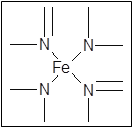
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为?,δ、α两种晶胞中铁原子的配位数之比为?。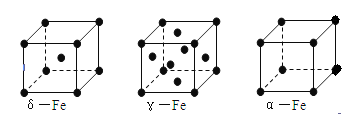
3、选择题 下列说法中错误的是(? )
A.当中心原子的配位数为6时,配合单元常呈八面体空间结构
B.[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键
C.配位数为4的配合物均为正四面体结构
D.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型
4、选择题 下列所述性质中能证明化合物微粒间一定存在离子键的是( )
A.易溶于水
B.具有较高的熔点
C.熔融状态下能导电
D.溶于水能电离出离子
5、选择题 短周期元素X、Y、Z、W、Q在周期表中的位置如图所示.下列说法中不正确的是( )
A.工业上获得Y、Q单质的方法通常是用电解法
B.形成简单离子的半径从小到大的顺序是:r(Y)<r(Q)<r(W)
C.Z的最高价氧化物可溶于水,也能溶于强碱溶液
D.X的气态氢化物浓溶液可用于检验管道氯气的泄漏