微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下叙述中不正确的是
A.氮族元素是位于周期表中第ⅤA族元素
B.氮族元素的最高正价与最低负价的绝对值之差等于2
C.硝酸是一种不稳定的强酸,具有强氧化性
D.王水是浓硝酸和浓盐酸(体积比3﹕1)的混合物
参考答案:D
本题解析:A、正确,氮族元素最外层是5个电子,位于周期表中第ⅤA族元素;B、正确,B.氮族元素的最高正价是+5价与最低负价-2价的绝对值之差等于2; C.正确,硝酸易分解,具有强氧化性; D.不正确,王水是浓硝酸和浓盐酸(体积比1﹕3)的混合物,盐酸应多些。选D。
本题难度:简单
2、填空题 下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
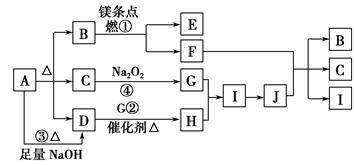
请填写以下空白:
(1)A的化学式?。
(2)定出反应①②的化学方程式:
①?,
②?。
(3)写出反应③的离子方程式:?。
(4)J与F反应的化学方程式:?。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为?mol。
参考答案:(1)NH4HCO3
(2)①2Mg+CO2  2MgO+C
2MgO+C
②4NH3+5O2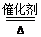 4NO+6H2O
4NO+6H2O
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
(4)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(5)0.2
本题解析:A分解得到等物质的量的B、C、D,A可能为NaHCO3或NH4HCO3,B与Mg反应,B应为CO2,C与Na2O2反应生成G,C可能为H2O,D与G在催化剂存在的条件下反应,D应为NH3,则H为NO,I为NO2,J为HNO3,HNO3与F反应又生成B (CO2)、C(H2O)、I(NO2),则F为C(碳)。
本题难度:一般
3、选择题 氨水显弱碱性的主要原因是
[? ]
A.通常状况下,氨的溶解度不大
B.氨水中的NH3·H2O电离出少量的OH-
C.溶于水的氨分子只有少量电离
D.氨本身的碱性弱
参考答案:B
本题解析:
本题难度:简单
4、填空题 氮可以形成多种离子,如N3-、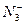 、
、 、
、 、
、 、
、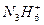 等,已知
等,已知 与
与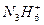 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于 的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
的性质,另外氮与氢也能形成NH3、N2H4、N3H5、N4H6、N5H7……
(1)一个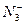 含有__________________________个电子,
含有__________________________个电子, 的电子式为____________。
的电子式为____________。
(2)形成 的中性分子的结构式是_____________________。
的中性分子的结构式是_____________________。
(3)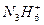 在强碱溶液中反应的离子方程式:_____________________________。
在强碱溶液中反应的离子方程式:_____________________________。
(4)NH3、N2H4、N3H5、N4H6、N5H7是否互为同系物,为什么?__________________________。
(5)写出N5H7可能的结构简式______________________________。
(6)这一系列化合物中N的质量分数最大值应小于____________%。
参考答案:(1)22? (各1分)
(各1分)
(2)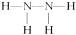 (2分)
(2分)
(3)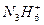 +OH-====N3H5+H2O(2分)
+OH-====N3H5+H2O(2分)
(4)互为同系物,因为它们的结构相似,组成上相差一个或若干个“NH”原子团(2分)
(5)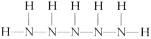 (2分)
(2分)
(6)93.3(2分)
本题解析:解答本题需要根据题目的条件对所学知识进行正向迁移,如果不能正确联系铵盐和同系物的知识,则必然会得出错误结论。因 与
与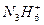 是由中性分子结合质子形成的,有类似于
是由中性分子结合质子形成的,有类似于 的性质,所以可以通过氨气和铵离子进行迁移分析
的性质,所以可以通过氨气和铵离子进行迁移分析 与
与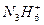 的性质。
的性质。
本题难度:简单
5、实验题 (15分)
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
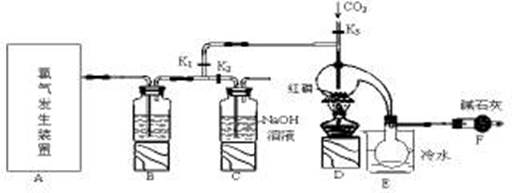
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
?
物质
| 熔点/℃
| 沸点/℃
|
PCl3
| -112
| 75.5
|
POCl3
| 2
| 105.3
|
请回答:
(1)写出A中反应的离子方程式?。
(2)B装置中所盛试剂是?;E中烧杯内冷水的作用是?。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把?,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是?。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 ?(填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3等钠盐)?mol,反应中转移电子的物质的量(n)的范围是?。
参考答案:(除标注外,每空2分,共15分)
(1)? MnO2?+ 4H+?+ 2Cl—△ Mn2+?+ Cl2↑+ 2H2O (其他合理答案均计分)
(2)?浓硫酸?冷凝,便于收集产品 (合理答案均计分)
(3)?玻璃管口用水润湿(合理答案均计分)
(4)?排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应(合理答案均计分)
(5)?蒸馏?
(6)? 0.15 (1分)? 0.15mol <? n <? 0.25mol (无单位此次不扣分)
本题解析:(1)A装置是产生氯气的装置,二氧化锰与浓盐酸加热制取氯气,离子方程式为 MnO2?+ 4H+?+ 2Cl—△ Mn2+?+ Cl2↑+ 2H2O ,或者用高锰酸钾溶液与浓盐酸不加热制取氯气;
(2)实验室常用红磷与干燥的Cl2制取PCl3,所以氯气需干燥后通入C中,B中盛放浓硫酸;PCl3的熔点较低,所以E中烧杯内冷水的作用是 冷凝,便于收集产品 ;
(3)玻璃管与橡胶管连接时,往往把胶管的一端用水浸湿,或把玻璃管口用水润湿,方便连接;
(4)因为PCl3遇O2会生成POCl3,所以装置内不能存在氧气,所以通入干燥CO2的目的排尽曲颈瓶中的空气,防止PCl3与O2等发生副反应生成POCl3;
(5)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离;
(6)300ml 1mol/L的NaOH溶液中Na元素的物质的量是0.3mol,根据元素守恒,生成的NaCl 、 NaClO 和 NaClO3等钠盐的总物质的量为0.3mol,所以需要氯气0.15mol;若只生成NaCl 、 NaClO ,则转移的电子最少为0.15mol×2×1/2=0.15mol,若只生成NaCl 、? NaClO3,则转移的电子最多,根据得失电子守恒,NaCl 、? NaClO3的物质的量之比是5:1,所以转移电子的物质的量为0.15mol×2×5/6=0.25mol,当三种产物都存在时转移电子的物质的量介于二者之间 0.15mol <? n <? 0.25mol 。
本题难度:一般