微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
A.浓硫酸
B.五氧化二磷
C.无水硫酸镁
D.甘油
参考答案:D
本题解析:A、浓硫酸具有吸水性,能使稀硝酸变为浓硝酸,A正确;B、五氧化二磷极易学吸水变为磷酸,所以能使稀硝酸变为浓硝酸,B正确;C、无水硫酸镁具有吸水性,能使稀硝酸变为浓硝酸,C正确;D、甘油是丙三醇与水互溶,不能使稀硝酸变为浓硝酸,D不正确,答案选D。
本题难度:简单
2、选择题 已知碱能除去硝酸尾气:NO+NO2+2NaOH=2NaNO2+H2O根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的是
A.1 mol O2和4 mol NO2
B.1 mol NO和4 mol NO2
C.1 mol O2和4 mol NO
D.4 mol NO和1 mol NO2
参考答案:D
本题解析:
本题难度:困难
3、计算题 (8分)已知;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)硝酸在该反应中表现出的性质为?
(2)若有8 mol电子发生转移,填写下列空白:
①被还原的硝酸的质量是?
②生成Cu(NO3)2的物质的量为??
③已知硝酸的体积为3.2L,假设硝酸全部参与 反应,则该硝酸的物质的量浓度为
反应,则该硝酸的物质的量浓度为 ?
?
参考答案:

本题解析:略
本题难度:一般
4、计算题 从某些方面看,氨和水相当,NH4+和H3O+(常写成H+)相当,NH2-和OH-相当,NH2-(有时还包括N3-)和O2-相当。已知在液氨中能发生下列两个反应:
NH4Cl+KNH2=KCl+2NH3
2NH4I+PbNH=PbI2+3NH3
请写出能在水溶液中发生与上述两反应相当的反应方程式。
参考答案:HCl+KOH=KCl+H2O
2HI+PbO=PbI2+H2O
本题解析:理清题给信息:NH4+和H3O+相当,NH2-和OH-相当,NH2-和O2-相当,然后将这些信息转换成解题所需信息(例如,NH4Cl相当于H3OCl,即HCl),并运用这些信息解题。有题给信息知,NH4Cl相当于H3OCl,即HCl,KNH2相当于KOH,NH3相当于H2O.所以液氨中发生的NH4Cl+KNH2=KCl+2NH3的反应相当于水溶液中发生的“酸+碱=盐+水”的中和反应,因而在水溶液中发生的与之相当的反应方程式为:
H3OCl+KOH=KCl+2H2O
可简写为:HCl+KOH=KCl+H2O
同理,NH4I相当于HI,PbNH相当于PbO,NH3相当于H2O,在液氨中发生的2NH4I+PbNH=PbI2+3NH3反应相当于水溶液中发生的“酸+碱性氧化物=盐+水”的反应,故在水溶液中发生的与之相当的反应方程式为:
2HI+PbO=PbI2+H2O
本题难度:简单
5、填空题 (10分)现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“ 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方 里哪些物质和起什么作用?。
里哪些物质和起什么作用?。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K)?L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为?L。
(3)配方中Fe2O3的量是如何控制的?。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式?。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸?。
参考答案:(10分)(1) NaN3分解供产生N2 ,陶土、SiO2吸附N2,Fe2O3使Na 变为Na2O 。
(2)V=6.9×0.082×300=169.7(L)
V=6.9×0.082× 350/4 =49.5(L)
(3) 6Na+Fe2O3=2Fe+3Na2O
(4)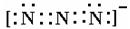 或
或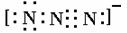
(5)原料粉碎、混匀、成型, 使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。
使反应快、扩散快,反应要足够快,使所释放的热“全”用于后续反应,而不使气袋明显升温。
本题解析:略
本题难度:一般