微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等质量的下列物质分别与等浓度的NaOH溶液反应至完全溶解,消耗碱量最多的是( )
A.Al
B.Al(OH)3
C.AlCl3
D.Al2O3
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列有关物质的表达式正确的是 (?)
A.乙炔分子的比例模型示意图:
B.溴乙烷的电子式: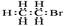
C.乙醇的结构简式:CH3CH2OH
D.1,3-丁二烯的分子式:C4H8
参考答案:C
本题解析:.乙炔分子为直线型,故A选项错误;溴乙烷的电子式中溴的孤对电子没有标出来,所以B选择错误;乙醇的结构简式为CH3CH2OH ,故C正确,为本题的正确答案;1,3-丁二烯的分子式为C4H6;故D错误。
点评:本题考查了化学术语,属于对基础知识的考查,本题考查的都是学生比较熟悉的,注意的是乙炔分子为直线型,本题难度适中。
本题难度:简单
3、实验题 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有 (填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有 。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:
a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为 。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有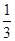 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
参考答案:(2)①Br2 ②Fe3+
(3)d 溶液呈血红色 b CCl4层呈无色
(4)①2Fe2++Br2=2Fe3++2Br- ②1.2 mol·L-1
本题解析:(2)①若氧化性Fe3+> Br2,则Br2不能氧化Fe2+,故溶液呈黄色是加入的Br2的颜色。②若氧化性Br2>Fe3+,则Br2能将Fe2+氧化成Fe3+,故溶液呈黄色是因为生成的Fe3+显黄色。(4)②氧化性Br2>Fe3+,则还原性Fe2+>Br-,Cl2通入FeBr2溶液中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。现有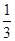 的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+
的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+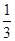 n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。
n(Br-)=0.20 mol,又因为n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。
本题难度:困难
4、填空题 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________g。
(2)钠?钾合金可在核反应堆中用作热交换液。5.05 g钠?钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
_____________________________________________________________
②计算并确定该钠?钾合金的化学式。
_____________________________________________________________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
已知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
_________________________________________________________________
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
?
| 氢氧化钠质量(g)
| 氯化钠质量(g)
|
①
| 2.40
| 3.51
|
②
| 2.32
| 2.34
|
③
| 3.48
| 3.51
|
?
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
参考答案:(1)78
(2)①0.75 mol/L?②NaK2
(3)4:5
(4)结论:实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
本题解析:(1)设需要叠氮化钠的质量为x。
2NaN3 2Na+3N2↑
2Na+3N2↑
2 mol×65 g/mol 3 mol×22.4 L/mol
? x 40.32 L
则x=78 g。
(2)①c(OH-)=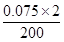 ×1000=0.75 mol/L
×1000=0.75 mol/L
②设上述合金中含a mol钠、b mol钾
a+b=0.075×2
23a+39b=5.05 a=0.050 mol b=0.10 mol
该钠?钾合金化学式为NaK2。
(3)溶液含氢氧化钠。氢氧化钠和二氧化碳反应生成的碳酸钠:
15-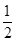 ×24=3 mol
×24=3 mol
112 L二氧化碳的物质的量: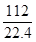 =5 mol
=5 mol
n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5
(4)由氯化钠质量推算,氢氧化钠样品摩尔质量为
M1(氢氧化钠)=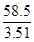 ×2.40=40 g/mol
×2.40=40 g/mol
M2(氢氧化钠)=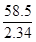 ×2.32=58 g/mol
×2.32=58 g/mol
M3(氢氧化钠)=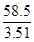 ×3.48=58 g/mol
×3.48=58 g/mol
结论:实验①所取氢氧化钠样品是NaOH;
实验②和实验③所取氢氧化钠样品应该是NaOH·H2O。
本题难度:一般
5、选择题 下列各项表达式正确的是
A.N2的电子式: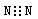
B.CO2的电子式 :O::C::O:
C.NaCl的电子式: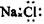
D.F- 的结构示意图: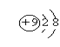
参考答案:D
本题解析:A不正确,氮气的电子式应该是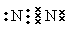 ;B不正确,CO2的电子式应该是
;B不正确,CO2的电子式应该是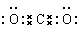 ;氯化钠是离子化合物,电子式应该是
;氯化钠是离子化合物,电子式应该是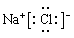 ,C不去,所以答案选D。
,C不去,所以答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般