微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
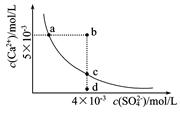
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:B
本题解析:A.a、c两点均在CaSO4在水中的沉淀溶解平衡曲线上,在平衡曲线上的点都可以表示常温下CaSO4溶于水所形成的饱和溶液的点。正确。B.a点与c点都是在相同温度下的CaSO4在水中的沉淀溶解平衡曲线上的点。因此a点对应的Ksp等于c点对应的Ksp。错误。C.在b点时由于c(Ca2+)·c(SO42-)= 5×10-3×4×10-3=2×10-5>9×l0-6.因此将有沉淀生成。正确。D. 向d点溶液中加入适量CaCl2固体,可以时溶液中的c(Ca2+)增大到c点。正确。
本题难度:一般
2、填空题 【化学——选修2:化学与技术】(15分)
某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:

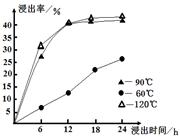
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4;
CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)= 。
(4)“沉淀”中含杂质离子主要有 ;“操作X”名称为 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
参考答案:(除标记外每空2分,共15分)
(1)12 90
(2)3,6,6,1,5,6(有错计0分,“1”未写本次不扣分)
(3)1.50(或1.5)
(4)SO42-、NH4+、Na+(少一个扣1分,有错计0分) 洗涤、低温干燥(各1分)
(5)0(1分) 7g
本题解析:(1)根据五行可知,温度太低浸出率较低,而90℃与120℃时的浸出率差不太多,而温度太高消耗的能量较多,生产成本大,所以最佳的温度是90℃,12小时时浸出率基本达到最大,再增长时间,浸出率增大不多,所以最佳的浸出时间是12小时;
(2)该反应不是氧化还原反应,所以只需按照质量守恒定律配平即可,Fe元素守恒,则硫酸铁的系数是3,Na2Fe6(SO4)4(OH)12的系数是1,则硫酸钠的系数是5,所以碳酸钠的系数是6,二氧化碳为6,水是6;
(3)加入过量NaF溶液,则生成MgF2和CaF2沉淀,则滤液为二者的饱和溶液,溶液中的氟离子浓度相等,所以滤液中的c(Ca2+)/c(Mg2+)= KSP(CaF2)/ KSP(MgF2)= 1.11×10-10/7.4×10-11=1.5;
(4)根据流程图分析,除铁、钙、镁的过程中都生成硫酸钠,加入草酸铵后生成草酸钴沉淀,则该沉淀中可能存在的杂质离子有SO42-、NH4+、Na+;将得到的沉淀洗涤以除去杂质离子,然后低温干燥,防止草酸钴分解;
(5)充电时,Li+还原为Li,则LiCoO2中Li的化合价是+1价,所以LiC6中Li的化合价Li的化合价是0价;放电时正极发生还原反应,则CoO2得到1个电子与锂离子结合为LiCoO2,所以放电时有1mole-转移,则有1mol LiCoO2生成,正极CoO2增加的质量即为1molLi的质量为7g。
考点:考查对图像的分析判断,化学方程式的配平,溶度积的应用,电化学反应原理的应用
本题难度:困难
3、选择题 已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13mol?L-1
B.加入Na2CO3固体,可能生成沉淀
C.所加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10mol?L-1
参考答案:A.pH=13的溶液中,c (H+)=10-13mol/L,故A正确;
B.加入Na2CO3固体,当c(Mg2+)×c(CO32-)>ksp(MgCO3)时,生成沉淀,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.溶液中的c (Mg2+)=5.6×10-12÷10-2=5.6×10-10 mol/L,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 常温下,CaSO4在水中的沉淀溶解平衡曲线如下图所示,Ksp(CaSO4)= 9.0×10-6。下列说法中正确的是

[? ]
A.通过蒸发可以使溶液由d点变到c点
B.a点对应的Ksp等于c点对应的Ksp
C.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol?L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀.是因为溶液中c(Zn2+)?c(S2-)>Ksp(ZnS)
C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小
D.AgCl在10mL?0.05mol?L-1的KCl溶液中比在20mL0.01mol?L-1的AgNO3溶液中溶解的质量少
参考答案:A、令饱和氯化银溶液c(AgCl)=xmol/L,则x?x=1.77×10-10,解得x≈1.33×10-5,令饱和溶液中c(Ag2CrO4)=ymol/L,则(2y)2×y=1.12×10-12,解得y=30.28
本题解析:
本题难度:简单