微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )
A.25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,向浓度均为0.1?mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1?mol?L-1的Na2CO3溶液,首先生成CaCO3沉淀
B.向硫酸亚铁溶液中加入氯水,再加入KSCN溶液,溶液变为红色,说明硫酸亚铁溶液中存在Fe3+
C.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
D.除去Cu粉中混有的CuO,可将混合物加入到稀硝酸中,充分反应后过滤、洗涤
参考答案:A.25℃时,MgCO3饱和溶液中c(Mg2+)=2.6×10-3mol?L-1,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol?L-1,则Ksp(MgCO3)=6.76×10-6>Ksp(CaCO3)=2.8×10-9,所以向浓度均为0.1?mol?L-1的MgCl2和CaCl2混合溶液中逐滴加入0.1?mol?L-1的Na2CO3溶液,首先生成CaCO3沉淀,故A正确;
B.因氯水具有氧化性,将亚铁离子氧化为铁离子,则向硫酸亚铁溶液中先加入KSCN溶液,不变色,再加入氯水溶液变为红色,说明硫酸亚铁溶液中存在Fe2+,故B错误;
C.AgCl也是不溶于水、不溶于酸的白色沉淀,则向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中可能含有Cl-或含有SO42-,但二者不能同时存在,故C错误;
D.因Cu与稀硝酸反应,则除去Cu粉中混有的CuO,可将混合物加入到稀盐酸(或稀硫酸)中,充分反应后过滤、洗涤,故D错误;
故选A.
本题解析:
本题难度:一般
2、选择题 (12分)稀土元素是周期表中ⅢB族钪、钇和镧系元素之总称,金属活泼性仅次于碱金属和碱土金属元素,它们的性质极为相似,常见化合价为+3价。无论是航天、航空、军事等高科技领域,还是传统工农业,稀土的应用几乎是无所不在。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表。
离子
| 开始沉淀时
的pH
| 完全沉淀时
的pH
|
Fe3+
| 2.7
| 3.7
|
Y3+
| 6.0
| 8.2
|
②Be(OH)2+2NaOH Na2BeO2+2H2O
Na2BeO2+2H2O
请回答下列问题:
(1)过滤Ⅲ所得滤液的溶质主要有______________。
(2)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(3)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= 。
Fe(OH)3+3H+的平衡常数K= 。
(4)写出煅烧过程的化学方程式 。
参考答案:(1)氯化铵、草酸铵
(2)①b ②BeO +4H+===Be2++2H2O
+4H+===Be2++2H2O
(3)2.5×10-5
(4)Y2(C2O4)3 Y2O3+3CO↑+3CO2↑
Y2O3+3CO↑+3CO2↑
本题解析:(1)钇矿石与氢氧化钠共熔,加水溶解后得硅酸钠溶液和铍酸钠溶液,同时还产生了氢氧化钇和三氧化二铁沉淀,加盐酸、氨水调节pH后加入草酸,此时的沉淀为草酸钇,溶液中存在氯化铵和草酸铵;
(2)①想从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用盐酸和氨水两种试剂,在适合的pH下即可形成沉淀;②Na2BeO2与足量盐酸发生反应,生成氯化铍、氯化钠和水,离子反应方程式为BeO +4H+===Be2++2H2O;
+4H+===Be2++2H2O;
(3)Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c(OH-)3,那么c3(OH-)=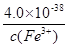 ,则c3(H+)=
,则c3(H+)=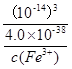 ,则,K=
,则,K=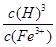 =2.5×10-5
=2.5×10-5
(4)煅烧草酸钇的方程式为Y2(C2O4)3 Y2O3+3CO↑+3CO2↑
Y2O3+3CO↑+3CO2↑
考点:物质的分离流程,化学反应方程式的书写,平衡常数的计算
本题难度:困难
3、填空题 SO2是硫酸工业尾气的主要成分。实验室中,拟用如图所示流程,测定标准状况下体积为V L的硫酸工业尾气中SO2的含量。
过量H2O2溶液步骤①过量Ba(OH)2溶液步骤②步骤③
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为____________________,1 mol H2O2参加反应,转移的电子数为________。
(2)步骤③的操作依次是过滤、________、________、称重。
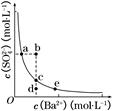
(3)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为________(填序号)。
①d→c→e?②b→c→d?③a→c→e?④d→c→a
(4)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
参考答案:(1)H2O2+SO2=2H++SO42- 1.204×1024
(2)洗涤 干燥
(3)不变 ③ 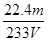 ×100%
×100%
本题解析:(1)H2O2具有氧化性,能与SO2发生氧化还原反应,离子方程式为H2O2+SO2=2H++SO42-,1 mol H2O2参加反应,转移2 mol电子。
(2)步骤③将沉淀过滤洗涤、干燥后称重。
(3)在滴加Ba(OH)2溶液的过程中,溶液的温度不变,Ksp不变,BaSO4在溶液中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42- (aq),加入Ba(OH)2溶液后,c(Ba2+)增大,但Ksp=c(Ba2+)·c(SO42-)不变,故c(SO42-)逐渐减小。由于温度不变,所以c(Ba2+)、c(SO42-)均在曲线上。
(4)根据S元素守恒有:SO2~BaSO4。据此可知SO2的物质的量为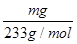 ,则标准状况下V L尾气中SO2的体积分数为
,则标准状况下V L尾气中SO2的体积分数为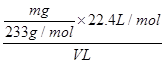 ×100%=
×100%=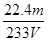 ×100%。
×100%。
本题难度:一般
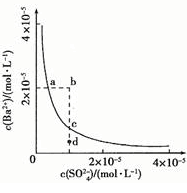
4、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
(提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡 常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数)
Ba2+(aq)+SO42-(aq)的平衡 常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数)
[? ]
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d 点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:
本题难度:一般
5、选择题 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
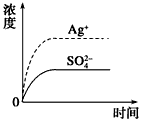
[? ]
A. 
B. 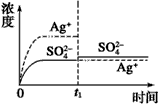
C. 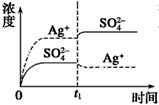
D. 
参考答案:B
本题解析:
本题难度:一般