微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在实验室我们也可以用下图所示的装置制取乙酸乙酯。

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是?。
(2)写出制取乙酸乙酯的化学方程式?。
(3)饱和碳酸钠溶液的主要作用除了吸收乙酸和乙醇外,还有?。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是?。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是?。
参考答案:(10分)(1)先加乙醇,再加浓硫酸,再加乙酸(2分)
(2)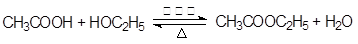 (2分)
(2分)
(3)便于分层和分离(其它合理答案如降低乙酸乙酯溶解度均可)(2分)
(4)防倒吸(2分)
(5)防止暴沸(2分)
本题解析:(1)由于浓硫酸溶于水会放出大量的热量,且密度大于水的,所以在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先加入乙醇后缓慢注入硫酸,不断搅拌,冷却后加醋酸。
(2)乙酸乙酯生成的化学方程式是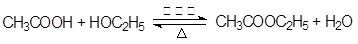 。
。
(3)由于生成的乙酸乙酯中混有乙酸和乙醇,所以饱和碳酸钠溶液的作用是反应乙酸、溶解乙醇、降低乙酸乙酯溶解度,利于酯的分层析出,且便于闻到乙酸乙酯的香味。
(4)由于乙酸和乙醇都是和水互溶的,所以导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中的目是防止倒吸。
(5)由于实验需要加热,所以做此实验时,向盛乙酸和乙醇的试管里加入几块碎瓷片的目的是防止暴沸。
点评:该题是高考中的常见考点,属于中等难度的试题。试题难易适中,侧重对学生基础性知识的巩固与训练,有助于培养学生综合实验能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题的难点是平衡状态的判断。
本题难度:一般
2、实验题 (15分)已知:BaSO4(s)+4C(s) 高温4CO(g)+BaS(s)
工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

(1)若按以上流程在实验室焙烧重晶石矿,回收处理所产生的气体,恰当的方法是?(填字母编号)。
a.用澄清石灰水吸收气体? b.用浓硫酸吸收气体? c.点燃气体
(2)焙烧重晶石矿时,可能发生的副反应的化学方程式是? (写两个)。
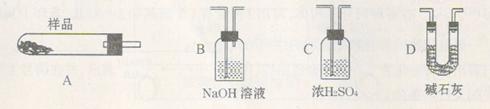
(3)为测定产品氯化钡晶体(BaCl2·nH2O)中的n值,设计下列实验步骤,请补充完善空缺项的实验步骤:①称量样品;②灼烧样品;③置于?(填仪器名称)中冷却;④?;⑤恒重操作。恒重操作的目的是?;若最终测出的n值偏大,可能的实验操作误差原因是?(举例一种情况)。
(4)用下列装置组合也可完成(3)中实验。请选择下列恰当的装置组合(称量、加热和夹持仪器省略),完成上述实验:?(用装置代号以“A ?
? ……
……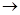 ”形式表示,每套装置不可重复使用)
”形式表示,每套装置不可重复使用)
(5)将重晶石矿与碳、氯化钙共同焙烧,可以直接得到氯化钡,反应的化学方程式为:
BaSO4+4C+CaCl2高温4CO +CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
+CaS+BaCl2。以下是从焙烧后的固体中分离得到氯化钡晶体的实验流程设计(已知硫化钙不溶于水,易溶于盐酸)。请在空格方框横线上填写操作名称。
参考答案:(1)c?(2)3C+2Fe2O3高温4Fe+3CO2↑、2C+SiO2高温Si+2CO↑
(3)干燥器;称量冷却后的氯化钡样品质量(或称量);保证氯化钡晶体脱水完全;加热前称量样品质量偏大(或最后称量样品质量偏小,或灼烧、转移样品时有样品损失等)
(4)A→C→D或A→D→C
(5)
本题解析:(1)根据已知信息可知硫酸钡与碳在高温下反应生成CO气体,CO与石灰水和浓硫酸等均不反应,但可以燃烧,因此回收处理所产生的气体,恰当的方法是点燃气体,答案选c。
(2)由于矿石中还含有氧化铁和二氧化硅,而在高温下二者均能与碳反应,反应的化学方程式分别为3C+2Fe2O3高温4Fe+3CO2↑、2C+SiO2高温Si+2CO↑。
(3)为防止吸收水蒸气,冷却应该在干燥器中完成;冷却后需要进行的操作是称量;为了保证氯化钡晶体脱水完全,需要恒重操作;若最终测出的n值偏大,可能的实验操作误差原因有加热前称量样品质量偏大或最后称量样品质量偏小,或灼烧、转移样品时有样品损失等。
(4)只需要测量出生成的水蒸气质量即可,而浓硫酸或碱石灰均可以吸收水蒸气,另外为了防止空气中的水蒸气影响,还需要防止空气中的水蒸气进入,因此正确的连接顺序是A→C→D或A→D→C。
(5)由于煅烧产生的硫化钡不溶于水,易溶于盐酸,因此将煅烧后的混合物溶解在水中过滤即得到氯化钡溶液,然后通过蒸发浓缩、冷却结晶即得到氯化钡晶体,最后过滤、洗涤、干燥、称量即可。
本题难度:一般
3、选择题 下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是(?)
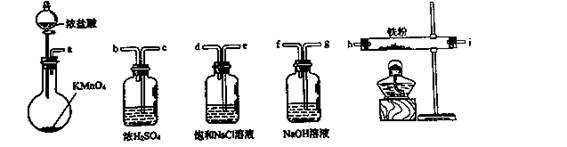
A.a-b-c-d-e-e-f-g-h
B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g
D.a-c-b-d-e-h-i-f
参考答案:B
本题解析:制备的氯气中含有氯化氢和水蒸气,用食盐水除去氯化氢,有水蒸气不能制得氯化铁,除去水蒸气用浓硫酸,应先除去水蒸气干燥氯气,干燥的氯气通入玻璃管中和铁反应生成无水氯化铁,最后吸收尾气中未反应的氯气,防止污染空气,洗气装置导气管长进短处,导气管口连接顺序为:a-e-d-c-b-h-i-g;
本题难度:一般
4、实验题 有下列实验装置如图:

示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B;向A中加入一定量适当浓度的盐酸,产生氢气。经必要的“操作”〔见问题(2)〕后,在导管的出口处点燃氢气,然后如图所示套上烧瓶B,塞紧瓶塞,氢气在烧瓶中继续燃烧,用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性:</PGN0035B.TXT/PGN>____。
(2)点燃氢气前必须进行____操作,进行该操作的方法是____。
(3)写出B、D中分别发生反应的化学方程式:
B中_______________
D中________________
(4)C中所盛干燥剂的名称是____;该干燥剂的作用是____。
参考答案:(1)在A中放入少量水,使水面刚浸没长颈漏斗下端,打开旋塞a,在烧瓶B底部稍加热,若在A漏斗颈内水面上升,且E中导管口有气泡逸出,表示装置不漏气。
(2)检验氢气纯度;用排水法(或向下排空气法)收集一小试管H2,用拇指堵住移近火焰,移开拇指,若没有尖锐的爆鸣声,表示H2纯度合格,可以点燃或收集。
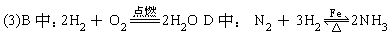
(4)C中:碱石灰;吸收气体中少量水蒸气和盐酸酸雾。
本题解析:本题综合考查了实验装置气密性的检查、氢气纯度的检验及NH3的合成等知识。
学生在回答问题时,容易出现的错误:检验装置气密性时习惯于用手捂热反应器的操作方法,并将此实验中使用的还原铁粉误当成是反应物,从而造成错误的判断。题中给出进入E中的气体能使酚酞变红,说明该气体溶于水应显碱性,因而排除了H2或O2的可能性;再根据B中H2燃烧时消耗掉O2,剩余的则是</PGN0087B.TXT/PGN>N2。其连同生成的H2经干燥剂干燥后在反应器D中在还原铁粉作催化剂的条件下反应生成NH3。据此写出D中反应的化学方程式为:N2+3H2 2NH3。
2NH3。
本题难度:一般
5、填空题 实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 ?mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):??.
①500mL量筒?②烧杯?③1000mL容量瓶?④500mL?容量瓶
⑤天平?⑥胶头滴管?⑦锥形瓶?⑧玻璃棒?
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度的影响(偏高,偏低,或不变)
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
参考答案:(1)100mL。(2)②④⑥⑧(3)A偏低B?偏低?C ?偏低D?偏低
本题解析:欲配制500mL的溶液,需用500mL的容量瓶。(1)需准确量取98%的硫酸的体积v=0.5L×3.68mol·L-1×98g/mol÷98%÷1.84g·cm-3=100mL;(2)量取98%的硫酸后,倒入烧杯,稀释,用玻璃棒进行搅拌,冷却至室温,转移入500mL?容量瓶,洗涤,定容,当距离刻度线1-2cm时改用胶头滴管,摇匀,则配制了一定浓度的溶液。故需用到的实验仪器有烧杯、玻璃棒、500mL?容量瓶和胶头滴管;(3)A烧杯和玻璃棒上面粘附有溶质,若没有洗涤或洗涤后洗涤液没有加入容量瓶,都会使所配制的溶液的浓度偏低;B部分稀硫酸外溅,溶质减小,故浓度偏低;C若加入过多的水,则使溶液的浓度偏小,将瓶内液体吸出,会吸出少量溶质,故溶液最终的浓度还是偏低,当加入过量的水时,只能倒掉重新配制;D 仰视时,溶剂过量,溶液的浓度偏低。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:一般