微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡下列叙述正确的是(?)
CH3COO-+H+,对于该平衡下列叙述正确的是(?)
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡正向移动
参考答案:B
本题解析:A选项中加入水时,c(CH3COO-)和c(H+)均减小,平衡向其浓度增大的方向(也就是正方向)移动;B选项加入的少量NaOH与H+反应,c(H+)变小,平衡正向移动;C选项中加入盐酸时c(H+)变大,平衡向逆反应方向移动,但最终c(H+)比未加盐酸前还要大;D选项加入CH3COONa固体,c(CH3COO-)增大,导致平衡逆向移动。
本题难度:一般
2、填空题 (Ⅰ)(9分)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①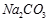 ②
②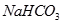
参考答案:
本题解析:
本题难度:一般
3、选择题 常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②NaOH溶液、③CH3COONa溶液.下列说法不正确的是( )
A.溶液的pH:②>③>①
B.水电离出的c(OH-):③>①>②
C.②和③等体积混合后的溶液:c(Na+)+c(H-)=c(OH-)+c(CH3COO-)
D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO)=0.1mol/L
参考答案:D
本题解析:
本题难度:简单
4、填空题 (14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=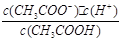 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=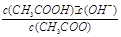 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1 草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显 性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
参考答案:(14分)
(1)Ka·Kh=Kw越大 小于 碱
(2)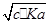 mol·L-1
mol·L-1
(3)②溶液的pH ③酸碱中和滴定
本题解析:(1)已知CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=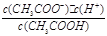 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=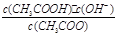 ,水的离子积常数Kw=c(H+)·c(OH-),所以对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是Ka·Kh=Kw,根据三者之间的关系式可知,弱电解质的电离程度越小,其对应的离子水解程度越大,因为碳酸的酸性小于草酸的酸性,所以在25 ℃时碳酸的K1小于草酸的K1,在碳酸氢钠溶液中,HCO3- 的水解程度大于其电离程度,碳酸氢钠的溶液显碱性。
,水的离子积常数Kw=c(H+)·c(OH-),所以对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是Ka·Kh=Kw,根据三者之间的关系式可知,弱电解质的电离程度越小,其对应的离子水解程度越大,因为碳酸的酸性小于草酸的酸性,所以在25 ℃时碳酸的K1小于草酸的K1,在碳酸氢钠溶液中,HCO3- 的水解程度大于其电离程度,碳酸氢钠的溶液显碱性。
(2)由于醋酸电离出的醋酸根离子与氢离子浓度近似相等,平衡时醋酸又可以看成是醋酸溶液的浓度,又知KwW=c(H+)·c(OH-),所以(H+)= 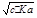 mol·L-1
mol·L-1
(3)根据Ka=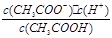 知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要想知道氢离子浓度必须测定溶液的pH值,要想知道醋酸浓度则必须利用酸碱中和滴定的方法测定,所以需测定的数据有:②溶液的pH ③用酸碱中和滴定测定溶液的浓度.
知,要测定电离平衡常数,则必须知道氢离子浓度和醋酸浓度,要想知道氢离子浓度必须测定溶液的pH值,要想知道醋酸浓度则必须利用酸碱中和滴定的方法测定,所以需测定的数据有:②溶液的pH ③用酸碱中和滴定测定溶液的浓度.
考点:考查电解质溶液中平衡常数的关系,溶液中离子浓度的计算,平衡常数的测定等知识。
本题难度:困难
5、选择题 常温时,下列叙述正确的是? (? )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中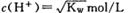
C.pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
参考答案:B
本题解析: A中稀释pH=3的醋酸,溶液中氢氧根浓度增大,错误;B.一定浓度的CH3COOH和NaOH混合,溶液呈中性,氢离子和氢氧根浓度相等,根据水的离子积常数,可得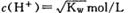 ,正确; C.pH均为11的NaOH和Na2CO3溶液中,前者是抑制了水的电离,后者是促进了水的电离,程度不相同,错误; D.由于醋酸是弱酸,pH与体积均相同的硫酸和醋酸,醋酸的物质的量多,消耗氢氧化钠的物质的量多,错误。
,正确; C.pH均为11的NaOH和Na2CO3溶液中,前者是抑制了水的电离,后者是促进了水的电离,程度不相同,错误; D.由于醋酸是弱酸,pH与体积均相同的硫酸和醋酸,醋酸的物质的量多,消耗氢氧化钠的物质的量多,错误。
本题难度:一般