微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某课外活动小组研究金属钾的性质.他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处.但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2).
完成下列问题:
(1)钾的原子核外有19个电子,画出钾的原了结构示意图______
(2)预测钾的化学性质,完成下列反应的化学方程式,并进行实验验证
①钾在氯气中燃烧______
②点燃钾剧烈燃烧______
③将小块钾投入冷水中______
(3)推测钾在自然界中的存在方式是______?(填“游离态”或“化合态”)
(4)该小组研究钾的性质时用到了哪些主要方法:______
他们是按照怎样的程序来研究金属钾的性质的:______.
2、推断题 四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表。试根据信息回答有关问题。
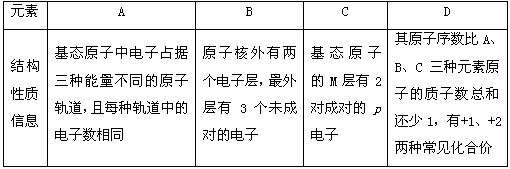
(1)写出D原子的外围电子排布式________,A、B、C、D四种元素的第一电离能最小的是_______(用元素符号表示)。
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点______(填“高”或“低”)。
(3) 元素F与A相邻且同主族,它们与氧元素的成键情况如下
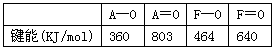
在A和O之间通过双键形成AO2分子,而F和O则不能和A那样形成有限分子,原因是___________________________。
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是____________(填序号)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.金属键
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
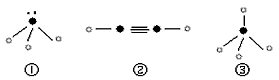
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填序号);在②的分子中有______个σ键和_______个π键。
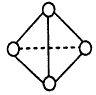
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量。试计算反应:B4(g)==2B2(g) △H=_______kJ/mol。
3、填空题 (1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
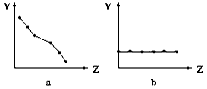

①ⅡA族元素的价电子数____________。
②第三周期元素的最高化合价__________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为________ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________ ,B的化学式为________。
③工业上制取单质M的化学方程式为_____________________________________。
4、选择题 元素X和Y元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5.则下列叙述不正确的是
A.X和Y两元素形成的化合物既可以和强酸反应,也可以和强碱反应
B.Y元素的单质不能盐酸反应
C.X的离子和Y的离子核外电子排布完全相同
D.X元素的一种单质能有效地吸收太阳光线中的紫外线
5、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
[? ]
A.化合物BmAm分子中所有原子一定共平面
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE具有相同类型的化学键