微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对一块铁进行防护,下列方法不正确的是(?)
A.合金
B.涂油
C.漆合金
D.埋在地下
参考答案:D
本题解析:A、合金能改变金属内部结构,对铁进行防护
B、涂油 可以和空气隔绝,能对铁进行防护
C、漆合金,可以隔绝空气,能对铁进行防护
D、埋在地下,地下比较潮湿,并且也有氧气,铁在潮湿的地下也会发生电化学腐蚀,起不到防护的作用。故选D。
本题难度:简单
2、选择题 钢铁在潮湿环境中发生电化学腐蚀时,正极所发生的主要反应是(?)
A.Fe-2e-=Fe2+
B.2H++2e-=H2↑
C.2H2O+O2+4e-=4OH-
D.4OH--4e-=2H2O+O2↑
参考答案:C
本题解析:钢铁在潮湿的环境中发生电化学腐蚀有两种类型:析氢腐蚀和吸氧腐蚀。在水膜酸性较强时发生析氢腐蚀,水膜中性或弱酸性时发生吸氧腐蚀,两者负极反应相同,只是正极反应不同。在通常情况下,水膜为弱酸性或中性,主要发生的是吸氧腐蚀,故选择吸氧腐蚀的正极反应:2H2O+O2+4e-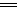 4OH-。
4OH-。
本题难度:一般
3、选择题 铜制品上的铝质铆钉,在潮湿空气中易腐蚀的原因可描述为
[? ]
A.形成原电池,铝作负极
B.形成原电源,铜作负极
C.形成原电池时,电流由铝经导线流向铜
D.铝质铆钉发生了化学腐蚀
参考答案:A
本题解析:
本题难度:简单
4、计算题 (9分)由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,当铜片上放出3.36 L(标准状况)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少个电子通过了导线?
(3)200 mL稀H2SO4的物质的量浓度是多少?
参考答案:(1)9.75 g
(2)1.806×1023个
(3)0.75 mol·L-1
本题解析:(1)Zn+2H+====Zn2++H2↑
6.5 g? 22.4 L
m(Zn)? 3.36 L
m(Zn)="9.75" g
(2)负极:Zn-2e-====Zn2+
正极:2H++2e-? ="===?" H2↑
2 mol? 22.4 L
m(e-)? 3.36 L
n(e-)="0.3" mol
通过导线的电子数为:0.3 mol×6.02×10-23 mol-1=1.806×1023个
(3)Cu片上:2H++2e-====H2↑
2 mol? 22.4
n(H+)? 3.36 L
n(H+)="0.3" mol则n(H2SO4)="0.15" mol,c(H2SO4)=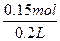 ="0.75" mol·L-1。
="0.75" mol·L-1。
本题难度:简单
5、选择题 下列做法不利于金属防护的是: ( )
A.菜刀切菜后不洗净就放回刀架
B.将钢铁制成不锈钢
C.在铁塔的表面喷油漆
D.埋在地下的钢管与锌块连接
参考答案:C
本题解析:菜刀不洗净放置容易生锈,A错误;不锈钢具有更好的抗腐蚀性能,所以将钢铁制成不锈钢可以防止生锈,B正确;涂油漆可以使金属与空气中的氧气隔绝,防止金属腐蚀,C正确;地下的钢管与锌块连接,由于锌块比铁活泼,所以形成原电池时,锌块做负极,被腐蚀,钢管做正极被保护,D正确;答案应选A。
本题难度:简单