微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,不正确的是:(?)
A.电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为:2Cl - -2e -=Cl2 ↑
B.酸性介质或碱性介质的氢氧燃料电池的正极反应式均为:O2 + 2H2O+ 4e- = 4OH -
C.精炼铜和电镀铜时,与电源负极相连的电极反应式均为: Cu2+ + 2e- =" Cu"
D.钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为:Fe-2e - = Fe2+
参考答案:B
本题解析:电解池中阳极失去电子,发生氧化反应。由于氯离子的放电能力强于OH-的,所以电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为:2Cl - -2e -=Cl2↑,A正确;B不正确,在酸性介质中,正极电极反应式是O2 + 4H+ + 4e- = 2H2O;电解池中与电源负极相连的是阴极,得到电子,发生还原反应,所以精炼铜和电镀铜时,与电源负极相连的电极反应式均为: Cu2+ + 2e- = Cu,选项C正确;在钢铁的电化学腐蚀中,铁都是在负极失去电子,而被氧化,选项D正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池和电解池的工作原理,特别是电极反应式的判断、离子的放电顺序,然后结合题意具体问题、具体分析即可。有利于激发学生的学习兴趣,增强学生的学习动力。
本题难度:简单
2、选择题 下列各装置中都盛有0.1 mol·Lˉ1的NaCl溶液,放置一定时间后,纯锌片的腐蚀速率由快到慢的顺序是

参考答案:A
本题解析:根据装置的特点可知,①是原电池,其中锌是负极,失去电子,被腐蚀。②是电解池,锌与电源的正极相连做阳极加快腐蚀;③是电解池,锌与电源的负极相连,做阴极,被保护;④是锌的化学腐蚀,所以纯锌片的腐蚀速率由快到慢的顺序是②①④③,答案选A。
本题难度:一般
3、选择题 下列关于原电池、电解池的叙述中正确的是
A.发生氧化反应的电极分别为负极和阴极
B.阴离子分别向负极和阴极迁移
C.电子流向分别由负极直接流向正极、阴极直接流向阳极
D.若都有一个电极质量减轻,应分别为负极和阳极
参考答案:D
本题解析:A、发生氧化反应的电极分别为负极和阳极,错误;B、阴离子分别向负极和阳极迁移,错误;C、电子流向分别由负极直接流向正极,电解池中电子由电源的负极流向阴极,由阳极流向电源的正极,电解质中无电子流动,错误;D、正确。
本题难度:一般
4、简答题 如图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物.
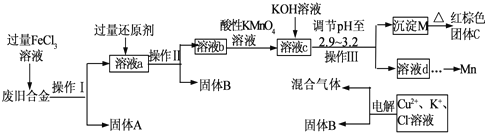
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是______.
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式:______.
(3)过量的还原剂应是______.
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为______.
②若用Xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为______g(用含X、Y的代数式表示).
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为:______.(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为______L(用含Z的代数式表示);该电极的反应式为______.
参考答案:(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,
故答案为:过滤;
(2)FeCl3具有氧化性,会把铁、铜氧化,反应方程式为:2FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2,
故答案为:FeCl3+Fe=3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2;
(3)根据流程最后滤液中含铜,加入过量的还原剂目的是还原过量的氯化铁,故应加铜,故答案为:铜粉;
(4)①溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②根据关系式计算:
2 MnO4-~10Fe2+~5Fe2O3
2105×160g
0.001XYm
m=0.001XY×5×160g2=0.4XY,
故答案为:0.4XY;
(5)因Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
溶度积常数越小,对应离子越易沉淀,故沉淀顺序为:Fe3+>Cu2+>Mn2+,
故答案为:Fe3+>Cu2+>Mn2+;
(6)由流程可知,电解氯化铜得到铜和氯气,生成Zg 铜转移电子数为:Zg64g/mol×2=Z32mol,生成氯气:Z64mol,要使两极得到气体体积相同,则还要电解水,设电解水的物质的量为x,根据反应式:2H2O通电.H2↑+O2↑可知,生成xmol氢气和0.5xmol氧气,根据两极气体体积相等可列出方程:Z64mol+0.5xmol=xmol,解得x=Z32,故生成氧气的物质的量为:Z64mol,标况下体积为:Z64mol×22.4L/mol=22.4Z64L,生成氧气的电极反应式为:4OH--4e-=O2↑+4H2O,
故答案为:22.4Z64;4OH--4e-=O2↑+4H2O.
本题解析:
本题难度:一般
5、选择题 如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)。下列有关说法正确的是 (?)
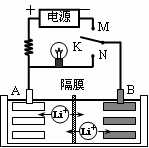
A.在整个充、放电过程中至少存在3种形式的能量转化
B.K与M相接时,A是阴极,发生还原反应
C.K与N相接时,Li+由A极区迁移到B极区
D.该电池的总反应式为Li1-xMnO2+LixC6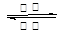 LiMnO2+C6
LiMnO2+C6
参考答案:A
本题解析:A、在整个充、放电过程中存存在能量转化的形式有:电能转化为化学能,化学能转变为电能,电能转化为光能,到少有三种形式的转换,正确;B、K与M相接时,A是阳极,发生氧化反应,错误;C、K与N相接时,A是电池的正极,Li+由B极区迁移到A极区,错误;D、反应物和产物反了,错误。
本题难度:一般