微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素
参考答案:C
本题解析:同周期自左向右,原子半径逐渐减小,则同周期元素中,IA族元素的原子半径最大,选项A不正确;同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,因此ⅥA族元素的原子,其半径越大,越难得到电子,选项B正确;室温下稀有气体单质都是气体,选项C正确;元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是金属元素,包括7个副族和1个第Ⅷ族,选项D不正确,答案选C。
点评:该题是中等难度的试题,主要是考查学生对元素周期表结构,以及灵活运用元素周期律解决实际问题的能力的培养,有利于培养学生的逻辑思维能力和灵活应变能力。熟练记住元素周期表的结构和元素周期律,是答题的关键。
本题难度:简单
2、选择题 X.Y两种元素形成含氧酸A和B,能说明酸A比酸B强的是
A.酸A中X的化合价比酸B中Y化合价高
B.酸A中X与酸B中Y在同一周期,且X在Y之后
C.酸A与酸B的铵盐溶液反应生成酸B
D.酸A具有强氧化性,酸B没有强氧化性
参考答案:C
本题解析:A.错误;B.最高价含氧酸的酸性看非金属性,同周期非金属性增强,最高价含氧酸的酸性强,题中没说是最高价含氧酸,错误;C.强酸制弱酸原理,正确;D.酸性的强弱与氧化性没有直接的关
系,错误。
本题难度:一般
3、选择题 如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是(?)
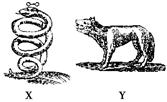
A.原子半径X<Y
B.最高价氧化物对应的水化物酸性X>Y
C.X的氢化物具有强还原性
D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强
参考答案:D
本题解析:X的氢化物为XH3,说明X处于V A族,XH3有剧毒。说明不是NH3,其具有强还原性,C正确。Y比X多1个电子层,则原子半径Y>X。X的非金属性强于Y,B正确。Y与碘同周期,则Y的非金属性比碘的弱,则Y的最高价氧化物对应的水化物的酸性比HIO4的弱。
本题难度:一般
4、填空题 请按要求填空:
I.现有:①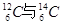 、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是?;(2)互为同素异形体的是?;(3)互为同分异构体的是?;(4)属于同一化合物的是?。
、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是?;(2)互为同素异形体的是?;(3)互为同分异构体的是?;(4)属于同一化合物的是?。
II.现有下列五种物质:①Ar?②CO2?③SiO2?④NaOH?⑤K2S,请按要求用序号填空:
(1)属于离子晶体的是?,属于原子晶体的是?,属于分子晶体的是?;
(2)只含共价键(不含分子间作用力)的是?,只存在离子键的是?,既存在离子键又存在共价键的是?,不存在化学键的是?。
参考答案:I.(1)①;(2)②④;(3)③⑥;(4)⑤
II. (1)④⑤,③,①②;?(2)③,⑤,④,①
本题解析:I、同素异形体,是指由同样的单一化学元素构成,但性质却不相同的单质。同分异构体,是指分子式相同,结构不同的物质。具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。
II.离子晶体,是指离子间通过离子键结合形成的晶体;原子晶体,是指相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体;分子晶体,指分子间以范德华力相互结合形成的晶体。(2)原子间通过共用电子对而形成的化学键叫共价键;离子键指阴离子、阳离子间通过静电作用形成的化学键。单原子分子不存在化学键,以分子间作用力结合。
点评:对化学基本概念的考查是高考必考知识点,难度不大,考生在平时的学习过程中应注意基本概念的准确定义和化学用语的规范使用。
本题难度:一般
5、选择题 下列有关电子云及示意图的说法正确的是(?)
A.电子云是笼罩在原子核外的云雾
B.小黑点多的区域表示电子多
C.小黑点疏的区域表示电子出现的机会少
D.电子云是用高速照相机拍摄的照片
参考答案:
 C
C
本题解析:考查电子云的概念及有关判断。电子云是电子在原子核外空间概率密度分布的形象化描述,电子在原子核外空间的某区域内出现,好像带负电荷的云笼罩在原子核的周围,人们形象地称它为“电子云”。电子云就是用小黑点疏密来表示空间各电子出现概率大小的一种图形。小黑点表示电子在核外空间某处出现的机会,不代表电子的运动轨迹;小黑点的疏密表示出现机会的多少,密则机会大,疏则机会小,所以正确的答案选C。
本题难度:简单