微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制取少量干燥的氨气涉及下列装置,其中正确的是
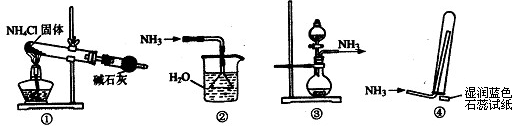
A.①是氨气发生装置
B.②是氨气吸收装置
C.③是氨气发生装置
D.④是氨气收集、检验装置
参考答案:C
本题解析:试题分析:选项A、氨气的制备不能用加热氯化铵固体的方法,因为氯化铵受热分解后生成的两种气体在试管口易反应,重新生成氯化铵固体。
选项B、氨气易溶于水,吸收氨气时应注意防止倒吸,而防止倒吸时,倒置的漏斗应接触液面即可,不可伸入液面下。
选项C、正确。其反应物为生石灰和浓氨水。生石灰具有吸水性,且能与水反应放出大量热,促进了氨气的逸出。
选项D、氨气的检验应用湿润的红色石蕊试纸,遇到氨气,变成蓝色。
考点:实验室制氨气
点评:本题综合考查了氨气的制备、收集、性质检验等方面的内容,属于较为综合的题目。但是所考查的知识点又都是较为基础的内容,考生只需熟练掌握即可解答。
本题难度:简单
2、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,W单质的熔、沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
参考答案:D
本题解析:Y原子的最外层电子数是内层电子数的3倍,核外各层电子数为2、6,应为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为S元素,W为Cl元素,
A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;
B、同周期元素从左到右元素的非金属性逐渐增强,根据元素的非金属性越强,对应最高价氧化物的水化物的酸性越强可知最高价氧化物对应水化物的酸性:W>Z,故B错误;
C、四种元素的单质中,常温下Z的单质是固体,其余均是气体,Z单质硫的熔、沸点最高,故C错误;
D、氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,故D正确.
故选D。
点评:本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期律的递变规律。
本题难度:简单
3、填空题 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
2
| ?
| ?
| ?
| ⑤
| ?
| ⑥
| ?
| ?
|
3
| ①
| ③
| ④
| ?
| ?
| ?
| ⑦
| ⑨
|
4
| ②
| ?
| ?
| ?
| ?
| ?
| ⑧
| ?
|
请回答:(1)形成化合物种类最多的元素是?(填元素符号)。
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是?(填化学式)。?
(3)①、②、③三种元素按离子半径由大到小的顺序依次为?(填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物电子式是 ?, 该元素另一种氢化物在常温下与 ②发生反应的化学方程式为?。
参考答案:(1)C (2)KOH (3) 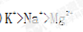 (4)
(4) 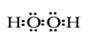 ?
?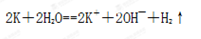
本题解析:①、②、③分别为钠,钾、铝,半径越大,碱性越强,所以碱性最强的是氢氧化钾,离子半径大小比较:电子层数越大,半径越大,电子层数相同,原子序数越大,半径越小。⑥元素为氧元素,所以形成具有强氧化性的氢化物双氧水。
本题难度:一般
4、填空题 下表列出了A-R 9种元素在周期表中的位置
周期族
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| O
|
2
| ?
| ?
| ?
| E
| ?
| F
| ?
| ?
|
3
| A
| C
| D
| ?
| ?
| ?
| G
| R
|
4
| B
| ?
| ?
| ?
| ?
| ?
| H
| ?
|
?
(1)填元素符号B??D?。其中B、D的最高价氧化物对应的水化物的碱性最弱的是?(填化学式)。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是?。
(3)F元素氢化物的化学式是?,该氢化物在常温下跟G元素形成的单质发生反应的化学方程式是?。
(4)G元素和H元素两者核电荷数之差是?。
参考答案:(1)K? Al? Al(OH)3? (2) Al(OH)3+OH-=AlO2-+2H2O;(3) H2O Cl2+H2O=HCl+HClO;
(4) 18。
本题解析:本题考查元素周期表的结构、常见元素在周期表中的位置及相关物质的性质。(1)B位于第四周期第ⅠA族,为钾元素,元素符号为K,D位于第三周期第ⅢA族,为铝元素,元素符号为Al;B、D的最高价氧化物对应的水化物分别为氢氧化钾和氢氧化铝,氢氧化钾为强碱,氢氧化铝为两性氢氧化物,碱性较弱的为Al(OH)3;(2)D元素的最高价氧化物对应的水化物氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式是Al(OH)3+OH-=AlO2-+2H2O;(3)F为氧元素,其氢化物的化学式为H2O,G为氯元素,氯气与水反应生成盐酸和次氯酸,化学方程式为Cl2+H2O=HCl+HClO;(4)G为氯元素,H为溴元素,根据原子序数差规律知,两者核电荷数之差为18。
本题难度:一般
5、选择题 短周期元素X、Y、Z、W在元素周期表中的相对位置如图6所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
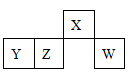
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液一定显酸性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的离子化合物XH5与水反应可产生两种气体
参考答案:D
本题解析:由题干信息可知W是硫,X是氮,Y是铝,Z是硅。A中同一周期从左到右原子半径依次是减小的,一般而言,原子的电子层数越多原子半径就越大,正确顺序为rY> rZ>rW>rX,错误;B是铝元素,其铝离子的盐溶液显酸性,其偏铝酸根离子的盐溶液显碱性,错误;C同一周期从到右非金属性增强,最简单气态氢化物的热稳定性也相应增强,应该是W>Z,错误;D 中XH5实际上是氢化铵NH4H,与水反应后生成氨气和氢气,正确;
本题难度:一般